Azomethine_ylide
アゾメチンイリドは窒素ベースの1,3-双極子であり、カルバニオンの隣にあるイミニウムイオンで構成されています。それらは、1,3-双極子付加環化反応で使用され、ピロリジンやピロリンなどの5員複素環を形成します。 これらの反応は高度に立体選択的および位置選択的であり、4つの新しい隣接する立体中心を形成する可能性がしたがって、アゾメチンイリドは、全合成、およびキラル配位子の形成において高い有用性を有し、医薬品。アゾメチンイリドは、アジリジン、イミン、イミニウムなど、多くのソースから生成できます。それらはしばしばその場で生成され、すぐに双極子親和性物質と反応します。
アゾメチンイリド
コンテンツ
1 構造
2 世代
2.1 アジリジンから 2.2 アルデヒドとアミンの縮合による 2.3 イミンとイミニウムから
2.3.1 N -metallation
2.4 ミュンヒノンから
3 1,3-双極子付加環化反応
3.1 付加環化の立体選択性 3.2 エナンチオ選択的合成
4 その他の反応
4.1 電子環状化
5 合成での使用
5.1 マルチネル酸の全合成 5.2 スピロトリプロスタチンAの全合成 5.3 ベンゾジアゼピノンの合成
6 参考文献
構造
以下の共鳴構造は、窒素に隣接する2つの炭素原子が負または正の電荷を持っている1,3-双極子の寄与を示しています。アゾメチンイリドの最も一般的な表現は、窒素が正に帯電し、負の電荷が2つの炭素原子間で共有される表現です。異なる共鳴構造の相対的な寄与は、各原子の置換基に依存します。電子求引性置換基を含む炭素は、近くの電子求引性基が負電荷を安定化する能力があるため、より部分的な負電荷を持ちます。

3つの異なるイリド形状が可能であり、それぞれが1,3-双極子付加環化反応の生成物に異なる立体化学をもたらします。W字型、U字型、S字型のイリドが可能です。 R置換基が同じ側にあるW字型およびU字型のイリドは、syn環状付加生成物を生成しますが、S字型のイリドはアンチ生成物を生成します。以下の例では、R 3置換基が生成物に含まれる場所は、置換基の立体的および電子的性質に依存します(1,3双極子付加環化反応の位置選択性を参照)。Rの立体化学1及びR 2付加環化生成物では、ダイポールから誘導されます。R 3の立体化学は、双極子親和性物質に由来します。双極子親和性物質が一置換(およびプロキラル)以上の場合、最大4つの新しい立体中心が生成物になる可能性が

世代
アジリジンから
参照:
アジリジン§1,3-双極子形成
アゾメチンイリドは、アジリジンの開環から生成することができます。 によればウッドワード・ホフマン則、サーマル4電子開環を介して進行conrotatory光化学反応がdisrotatoryであるのに対し、プロセス。

この開環反応では、トルク選択性の問題が電気陰性置換基は、窒素上のR置換基と同じ側に向かって外側に回転することを好みますが、電気陽性置換基は内側に回転することを好みます。
アジリジンでは、開環によって異なる1,3-双極子が生じる可能性があり、C-C結合ではなくC-N結合が切断されることに注意して
アルデヒドとアミンの縮合による

アゾメチンイリドを形成する最も簡単な方法の1つは、アルデヒドとアミンの縮合によるものです。アミンは、α炭素上の電子吸引性基を含む場合、などのエステル、脱プロトン化が容易に起こります。この方法を使用することの考えられる欠点は、エステルが最終的に付加環化生成物になることです。別の方法は、カルボン酸を使用することです。これは、脱炭酸によって付加環化プロセス中に簡単に除去できます。
イミンとイミニウムから

アゾメチンイリドは、イミンの脱プロトン化によって直接形成することもできます。
N -metallation
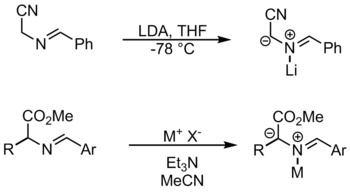
この反応で使用される金属試薬には、臭化リチウムと酢酸銀が含まれます。この方法では、脱プロトン化のために基質を活性化するために、金属がニトロゲンに配位します。イミンからアゾメチンイリドを形成する別の方法は、プロトトロピーおよびアルキル化によるものです。
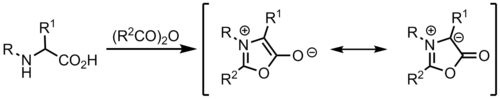
ミュンヒノンから
イリドは、メソイオン複素環であるミュンヒノンから形成され、環状アゾメチンイリドとして機能します。
1,3-双極子付加環化反応
1,3-双極子付加環化反応

1,3-双極子とπ系の他の付加環化反応と同様に、アゾメチンイリドを使用した1,3-双極子付加環化反応は6電子プロセスです。よるウッドワード・ホフマン則、この添加はsuprafacial双極子との両方に関してジポラロフィル。反応は一般に協調していると見なされ、2つの炭素-炭素結合が同時に形成されますが、非同期に形成されます。ただし、双極子および双極子親和性物質の性質に応じて、ジラジカルまたは双性イオン中間体が可能です。エンド製品は、一般的に等電子のように、好まれるディールス・アルダー反応。これらの反応では、アゾメチンイリドは通常HOMOであり、電子不足の双極子親和性物質はLUMOですが、特に環化が分子内の場合、非活性化π系との付加環化反応が起こることが知られています。 1,3-双極子付加環化反応のフロンティア分子軌道理論の説明については、1,3-双極子付加環化反応#フロンティア分子軌道理論を参照して
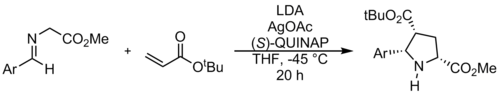
アゾメチンイリドの1,3-双極子付加環化反応は、一般に、アルケンまたはアルキンを双極子親和性物質として使用して、それぞれピロリジンまたはピロリンを形成します。アゾメチンイリドとアルケンの反応を上に示し、ピロリジンを生成します。この種の反応は、ウラジンの合成に使用できます。双極子親和性物質は通常、α、β-不飽和カルボニル化合物ですが、新しいタイプの双極子親和性物質の開発において最近多くの進歩がありました。
双極子と双極子親和性物質が同じ分子の一部である場合、分子内環化反応はかなり複雑な多環式生成物をもたらす可能性が双極子が双極子の炭素につながれている場合、融合した自転車が形成されます。それが窒素につながれている場合、ブリッジ構造が生じます。反応の分子内の性質は、位置選択性がしばしば制約されるという点でも有用である可能性が分子内反応のもう1つの利点は、双極子親和性物質が電子不足である必要がないことです。以下に示すマルチネル酸の合成など、電子豊富なアルキル置換双極子親和性物質による環化反応の多くの例が報告されています。
付加環化の立体選択性
1,3-双極子付加環化反応§立体選択性
双極子の立体化学が失われるか存在しないほとんどの1,3-双極子付加環化反応とは異なり、アゾメチンイリドはそれらの立体化学を保持することができます。これは一般に、アジリジンの開環と、それに続く立体化学がスクランブルする前の双極子親和性物質によるトラップによって行われます。
他の1,3-双極子付加環化反応と同様に、アゾメチンイリド付加環化反応はエンドまたはエキソ生成物を形成する可能性がこの選択性は、金属触媒作用を使用して調整できます。
エナンチオ選択的合成
キラル触媒を使用したアゾメチンイリドのエナンチオ選択的環状付加は、1991年のAllwayとGriggによる独創的な研究で最初に説明されました。この強力な方法は、JørgensenとZhangによってさらに開発されました。これらの反応は通常、亜鉛、銀、銅、ニッケル、およびカルシウムの錯体を使用します。
キラルホスフィン触媒を使用して、鏡像異性的に純粋なスピロインドリノンを合成することができます。Gongらによって記述された方法。電子効果に従わない予期しない位置化学的結果につながります。これは、触媒との良好なパイスタッキングに起因します。
その他の反応編集
電子環状化
コンジュゲートおよび – -アゾメチンイリドは、が可能であるelectrocyclizations。ジフェニルエテニル置換アゾメチンイリドの-電子環状化の例を以下に示します。この同旋性の閉環に続いて、表面上-水素化物シフトが起こり、再オマティック化された生成物が得られます。反応するフェニル環の立体障害と形状は、反応の成功に大きな役割を果たします。

このタイプの電子環状化から生じる化合物は、化合物をフラーレンに結合させるためのディールス・アルダー反応のジエンとして使用されてきました。
合成での使用
マルチネル酸の全合成

マルチネル酸の全合成には、アゾメチンイリドと非活性化アルケンの付加環化反応を使用しました。付加環化ステップは、ピロリジンを含む2つの環と、2つの立体中心を形成しました。
スピロトリプロスタチンAの全合成

スピロトリプロスタチンAの合成では、アミンとアルデヒドの縮合からアゾメチンイリドが形成されます。イリドは、その後に電子欠損アルケンと反応インドリノンの形成をもたらす、スピロピロリジンおよび4つの連続立体。
ベンゾジアゼピノンの合成
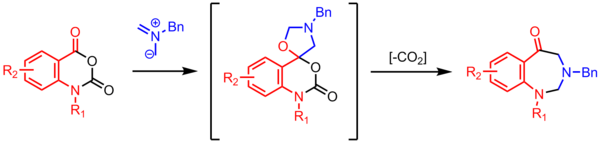
カルボニル基を有するアゾメチンイリドの環化は、スピロ得オキサゾリジンCO失い、2 7員環を形成することを。これらの高効用脱炭酸多段階反応は、アゾメチンイリド化学で一般的です。
参考文献
^ コールダム、イアン; ハフトン、リチャード(2005)。「アゾメチンイリドの分子内双極子付加環化反応」。ケミカルレビュー。105(7):2765–2809。土井:10.1021 / cr040004c。PMID 16011324。
^ パドワ、アルバート; ピアソン、ウィリアムH。; ハーウッド、LM; ビッカース、RJ(2003)。「第3章アゾメチンイリド」。複素環および天然物に向けた1,3-双極子環状付加化学の合成応用。複素環式化合物の化学:一連のモノグラフ。59。pp。169–252。土井:10.1002 /0471221902.ch3。ISBN 9780471387268。
^ アドリオ、ハビエル; Carretero、Juan C.(2011)。「アゾメチンイリドの金属触媒によるエナンチオ選択的1,3-双極子付加環化反応における新しい双極子親和性物質と双極子」。ケミカルコミュニケーションズ。47(24):6784–6794。土井:10.1039 / c1cc10779h。PMID 21472157。 ^ ドーバン、フィリップ; ギヨーム、マリク(2009)。「アジリジンから明らかにされたマスクされた1,3-双極子」。アンゲヴァンテケミーインターナショナルエディション。48(48):9026–9029。土井:10.1002 /anie.200904941。PMID 19882612。 ^ フーズゲン、ロルフ; Scheer、Wolfgang; フーバー、ヘルムート(1967)。「シス-トランス異性体アジリジンの開鎖アゾメチンイリドへの立体特異的変換」。アメリカ化学会誌。89(7):1753–1755。土井:10.1021 / ja00983a052。
^ Banks、Harold D.(2010)。「置換アジリジンからのアゾメチンイリドの生成におけるトルク選択性研究」。Journal of OrganicChemistry。75(8):2510–2517。土井:10.1021 / jo902600y。PMID 20329779。 ^ Cardoso、Ana L。; Pinho e Melo、Teresa MVD(2012)。「正式な環状付加におけるアジリジン:5員複素環の合成」。European Journal of Organic Chemistry(33):6479–6501。土井:10.1002 /ejoc.201200406。
^ Huie、Edward(1983)。「分子内付加環化経路は炭素架橋ジベンゾシクロヘプタンおよびジベンズアゼピンへ」。Journal of OrganicChemistry。48(18):2994–2997。土井:10.1021 / jo00166a011。
^ パドワ、アルバート; ギングリッチ、ヘンリーL。; リム、リチャード(1982)。「分子内ミュンヒノン環状付加の位置化学:分取的および機構的意味」。Journal of OrganicChemistry。47(12):2447–2456。土井:10.1021 / jo00133a041。
^ Li、Yi; Houk、Kendall N。; ゴンザレス、ハビエル(1995)。「ペリ環状反応遷移状態」。化学研究のアカウント。20(2):81–90。土井:10.1021 / ar00050a004。
^ ヒースコック、クレイトンH。; ヘンケ、ブラッドR。; Kouklis、Andrew J.(1992)。「安定化されたアゾメチンイリドの非活性化双極子親和性物質への分子内1,3-双極子環状付加」。Journal of OrganicChemistry。57(56):7056–7066。土井:10.1021 / jo00052a015。
^ Streiber、SL(2003)。「アゾメチンイリドの触媒的不斉環状付加。多様性指向合成のための多用途の段階的3成分反応の開発」。アメリカ化学会誌。125(34):10174〜10175。土井:10.1021 / ja036558z。PMID 12926931。 ^ R.バーガー、M。ワーグナー、X。フェン、K。ミュレン。「多環芳香族アゾメチンイリド:拡張多環芳香族へのユニークなエントリー」。2014. 436–441。土井:10.1039 / C4SC02793K ^ アドリオ、ハビエル; Carreter、Juan C.(2011)。「アゾメチンイリドの金属触媒によるエナンチオ選択的1,3-双極子付加環化反応における新しい双極子親和性物質と双極子」。ケミカルコミュニケーションズ。47(24):6784–6794。土井:10.1039 / c1cc10779h。PMID 21472157。 ^ 張、Xumu; ラグナス、マラティ; Gao、Wenzhong(2005)。「Cu(I)触媒によるアゾメチンイリドとアクリレートの高度にエキソ選択的およびエナンチオ選択的な環化付加」。OrganicLetters。7(19):4241–4244。土井:10.1021 / ol0516925。PMID 16146397。 ^ 福澤諭一; 大浦一郎; 清水健太; 緒方賢一(2010)。「銀(I)/チオクリックフェロホス錯体によって触媒されるα-エノンとアゾメチンイリドの高度にエンド選択的およびエナンチオ選択的な1,3-双極子環状付加」。OrganicLetters。12(8):1752–1755。土井:10.1021 / ol100336q。PMID 20232852。 ^ とにかく、フィリップ; グリッグ、ロナルド(1991)。「グリシンのアリーリデンイミンから誘導されたアゾメチンイリドの1,3-双極子付加環化反応のためのキラルコバルト(II)およびマンガン(II)触媒」。テトラへドロンレターズ。32(41):5817–5820。土井:10.1016 / S0040-4039(00)93563-9。
^ 公劉、劉朱; Chen、Xiao-Hua; 魏、強; Luo、Shi-Wei; シャオ、ハン(2009)。「高いエナンチオ純度と構造的多様性を備えたスピロ[ピロリジン-3,3′-オキシインドール]の有機触媒合成」。アメリカ化学会誌。131(38):13819–13825。土井:10.1021 / ja905302f。PMID 19736987。 ^ Nedolya、NA; トロフィモフ、BA(2013)。「-アゼピン誘導体の合成における電子環状化反応」。複素環式化合物の化学。49(1):152–176。土井:10.1007 / s10593-013-1236-y。
^ Nyerges、Miklós(2006)。「安定化されたα、β:γ、δ-不飽和アゾメチンイリドの1,7-電子環状化反応」。四面体。16(24):5725–5735。土井:10.1016 /j.tet.2006.03.088。
^ Nierengarten、Jean-François(2002)。「予想される1,3-双極子付加環化反応ではなく、フラーレンコアでの予想外のディールスアルダー反応」。化学。コミュン。(7):712–713。土井:10.1039 / B201122K。
^ スナイダー、BB; アン、Y。; オヘア、SM(2001)。「(±)-マルチネル酸の全合成」。OrganicLetters。3(26):4217–4220。土井:10.1021 / ol016884o。
^ ウィリアムズ、ロバート(2003)。「スピロトリプロスタチンAの簡潔で非対称な全合成」。OrganicLetters。5(17):3135–3137。土井:10.1021 / ol0351910。PMID 12917000。 ^ ライアン、ジョンH.(2011)。「アゾメチンイリドとイサト酸無水物との1,3-双極子付加環化脱炭酸反応:新規ベンゾジアゼピノンの形成」。OrganicLetters。13(3):486–489。土井:10.1021 / ol102824k。PMID 21175141。 “