Azurin
アズリンは、シュードモナス属、ボルデテラ属、またはアルカリゲネス属の細菌に見られる小さなペリプラズムの細菌性青銅タンパク質です。アズリンは、Cu(I)とCu(II)の間で酸化還元を受けることにより、シトクロム鎖に関連する酵素間の単一電子移動を緩和します。アズリンテトラマーの各モノマーの分子量は約14kDaで、銅原子が1つ含まれ、濃い青色で、308nmを中心とする蛍光発光バンドが
あずりん
アズリン四量体、緑膿菌
識別子
シンボル
銅バインドPfam F00127 SCOP2
5azu / SCOPe / SUPFAMCDD d13922
利用可能なタンパク質構造:
Pfam
構造/ ECOD PDB RCSB PDB ; PDBe ; PDBj PDBsum 構造の概要
アズリンと、シューが参加脱窒細菌の処理、のグラム陰性細菌を含む緑膿菌、シトクロムC551と相互作用することによって。以下からのアズリン緑膿菌は、タイプI青銅タンパク質シトクロムc 551(9キロダルトン)であるが、(キュプレドキシン)ヘム含有シトクロムは。アズリンは活性部位の近くに比較的大きな疎水性パッチを持っており、この疎水性パッチの2つの残基、Met-44とMet-64は、レドックスパートナーであるシトクロムc551と亜硝酸レダクターゼとの相互作用に関与していると考えられています。
その電子伝達特性とは無関係ですが、アズリンは腫瘍抑制タンパク質p53との相互作用を通じて抗癌特性を持っていることがわかっています。
コンテンツ
1 タンパク質機能
2 タンパク質の構造
3 生物学的機能
4 病気の関連性
5 も参照してください
6 参考文献
タンパク質機能
酸化型では、アズリン(Cu 2+ Az)はそのレドックスパートナーから電子を受け取り、次の反応に従って還元されます。
銅2+アリゾナ+ E – – >銅+ Azの
酸化還元電位は310mVです。
アズリンの高度に相互接続されたベータシート構造は、その電子伝達中心(銅結合側)と強く結合しています。水素結合がアズリンの長距離電子移動メカニズムに役割を果たすことを示唆する、かなりの実験的証拠が存在します。まとめると、これらの観察結果は、電子がそのポリペプチドと水素結合に沿ってタンパク質を通り抜けることを示唆しており、アズリンを作ることは、長距離のタンパク質内電子移動(LRET)を研究するための有用なモデルシステムです。
タンパク質の構造
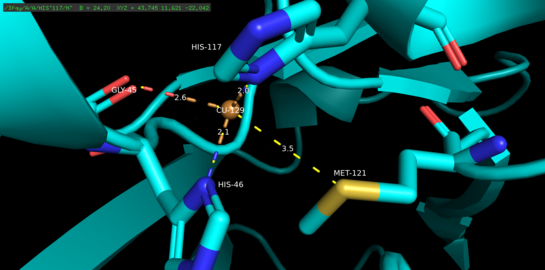
PyMolでレンダリングされたアズリンの銅結合ドメイン。5つの銅結合リガンドのうち4つがラベル付けされています。銅原子から個々の配位子までの距離(オングストローム)が記録されています。
アズリンは、重さが約14 kDaの単量体タンパク質であり、128個のアミノ酸で構成され、8個のベータストランドを形成してベータバレルを形成します。ストランドは、順番と単一のアルファヘリックス挿入によって接続されています。単一原子の銅結合部位は、各モノマーの表面から北端に向かって約7Å下にそこに生息する銅原子は、広範な疎水性パッチに囲まれた5つの配位子によって調整されています。
3つの赤道銅配位子はチオレート(Cys112)と2つのイミダゾール(His46、His117)で構成され、Gly45とMet121のカルボニル酸素原子は2つの弱い軸配位子として機能します。 Gly45を除いて、上記の銅結合構成は、これまでに決定されたすべての青色の1型銅結合タンパク質の構造に共通しています。配位されると、配位子-金属錯体は、銅(Cu(II))酸化状態と比較して、タンパク質の銅(Cu(I))還元状態を安定化する歪んだ三角錐形の形状を取ります。銅のd軌道とその配位子のp軌道の間に構造的に課せられた逆結合は、銅の状態をさらに安定させる可能性が
アズリンに関する既存の構造情報は、主にタンパク質の単一部位変異型のX線結晶学研究から得られました。結晶学によって解明された注目すべき構造的特徴には、8つのインターロッキングベータストランドから形成されたベータサンドイッチモチーフと、ベータシート4と5をつなぐバレルの外側のアルファヘリックスセグメントが含まれます。
Cu(I)/ Cu(II)の酸化還元ポテンシャルは通常、他のほとんどの銅錯体よりもアズリンの方が高いですが、Met121(アズリンの赤道銅配位配位子の1つ)が置き換えられた構造研究では、チオレート銅が存在しないことが示されています121位の大きな疎水性残基も銅原子の酸化還元電位を上昇させるため、配位子は高い還元電位を排除しません。したがって、より高い酸化還元電位は、かさばる疎水性残基の存在によって増強される状態である、金属結合部位からの水の排除に起因している。
逆に、負に帯電した残基は、より正に帯電した銅イオンの第二銅形態を安定化するため、酸化還元電位を低下させます。
生物学的機能
アズリンは、窒素固定生物で発現すると、窒素循環の脱窒経路の酵素である亜硝酸レダクターゼへの電子供与体として機能します。
アズリンは、芳香族アミンデヒドロゲナーゼからチトクロームオキシダーゼへ、および一部のc型チトクロームから亜硝酸レダクターゼへ電子を渡すことにより、第一級アミンの酸化的脱アミノ化をサポートします。
病気の関連性
アズリンは、がんを含むさまざまな病気の潜在的な治療法として大きな注目を集めています。インビボでは、生物への毒性作用を最小限に抑えながら、ヒト黒色腫および乳がん組織の退縮を誘発することが実証されています。
アズリンは、酵素の拡張されたアルファヘリックス領域にほぼ対応する酵素のp28ドメインを介して優先的に癌細胞に侵入します。癌細胞では、アズリンはp53と複合体を形成し、それを安定化させ、タンパク質に結合して破壊の印を付けるE3ユビキチンリガーゼとの結合を防ぎます。 4つのアズリン分子が各p53モノマーに高い親和性で結合します。 p53 /アズリン複合体は核に移動し、そこでp53はアポトーシス促進遺伝子BaxおよびNoxaの転写をアップレギュレートします。 P53はまた、細胞周期阻害剤の発現を活性化し、腫瘍細胞がG1期またはS期を超えて進行するのを防ぎます。この経路はアズリンの抗癌活性に重要な役割を果たしていますが、アズリンとp53の間の相互作用の詳細はよく理解され
米国での第I相臨床試験では、アズリンのp28アミノ酸フラグメントで治療された15人のステージIVのがん患者において、部分的および完全な腫瘍退縮効果の両方が示されました。 p28フラグメントを用いた別の第I相試験では、脳腫瘍の小児患者に対するアズリンの治療効果が実証されました。その後、USFDAは神経膠腫の希少疾病用医薬品としてp28の指定を承認しました。
アズリンの他のドメインも、癌細胞に血管新生を誘導するEphB2受容体などの細胞表面受容体チロシンキナーゼに結合することにより、強力な抗癌活性を示す可能性がこれは、アズリンがその治療効果を発揮するる別のメカニズムです。
も参照してください
銅結合タンパク質のプラストシアニンファミリー
参考文献
^ Rienzo F、Gabdoulline RR、Menziani MC、Wade RC。「青い銅タンパク質:それらの分子相互作用特性の比較分析」。タンパク質科学。9(8):1439–54。土井:10.1110 /ps.9.8.1439。PMC 2144732。PMID 10975566。
^ 山田T、後藤M、Punj V、Zaborina O、Kimbara K、Das Gupta TK、Chakrabarty AM。「細菌のレドックスタンパク質アズリンは、腫瘍抑制タンパク質p53の複合体形成と安定化を通じて、J774マクロファージのアポトーシスを誘導します」。感染と免疫。70(12):7054–62。土井:10.1128 /IAI.70.12.7054-7062.2002。PMC 133031。PMID 12438386。 ^ van den Bosch M、Swart M、Snijders JG、Berendsen HJ、Mark AE、Oostenbrink C、van Gunsteren WF、Canters GW。「タンパク質アズリンといくつかの変異体の酸化還元電位の計算」。ChemBioChem。6(4):738–46。土井:10.1002 /cbic.200400244。PMID 15747387。 ^ Arcangeli C、Bizzarri AR、Cannistraro S(1999年4月)。「銅アズリンの長期分子動力学シミュレーション:構造、動力学および機能性」。生物物理化学。78(3):247–57。土井:10.1016 / S0301-4622(99)00029-0。PMID 17030312。
^ 井上T、西尾N、鈴木S、片岡K、小妻T、甲斐Y(1999年6月)。「アクロモバクターシクロクラストからの酸化および還元シュードアズリンの結晶構造決定。遠隔ヒスチジンでの水素結合の再配列を伴うレドックス形態の銅部位の協調運動」。Journal of BiologicalChemistry。274(25):17845–52。土井:10.1074 /jbc.274.25.17845。PMID 10364229。 ^ van de Kamp M、Silvestrini MC、Brunori M、Van Beeumen J、Hali FC、Canters GW(1990年11月)。「シトクロムC551および亜硝酸レダクターゼとの電子伝達反応におけるアズリンの疎水性パッチの関与」。European Journal ofBiochemistry。194(1):109–18。土井:10.1111 /j.1432-1033.1990.tb19434.x。PMID 2174771。 ^ Opella SJ、DeSilva TM、Veglia G。「金属結合配列の構造生物学」。ケミカルバイオロジーにおける現在の意見。6(2):217–23。土井:10.1016 / S1367-5931(02)00314-9。PMID 12039007。 ^ McLaughlin MP、Retegan M、Bill E、Payne TM、Shafaat HS、PeñaS、Sudhamsu J、Ensign AA、Crane BR、Neese F、Holland PL。「小分子結合ポケットを備えた低配位の非ヘム鉄部位のタンパク質足場としてのアズリン」。アメリカ化学会誌。134(48):19746–57。土井:10.1021 / ja308346b。PMC 3515693。PMID 23167247。 ^ Vijgenboom E、Busch JE、Canters GW(1997年9月)。「インビボ研究は、緑膿菌の脱窒におけるアズリンの義務的な役割を反証し、アズの発現がrpoSおよびANRの制御下にあることを示している」。微生物学。143(9):2853–63。土井:10.1099 / 00221287-143-9-2853。PMID 9308169。 ^ Dodd FE、Hasnain SS、Hunter WN、Abraham ZH、Debenham M、Kanzler H、Eldridge M、Eady RR、Ambler RP、Smith BE(1995年8月)。「Alcaligenesxylosoxidans(NCIMB 11015)における2つの異なるアズリンの証拠:亜硝酸レダクターゼへの潜在的な電子供与体」。生化学。34(32):10180–6。土井:10.1021 / bi00032a011。PMID 7640272。 ^ Bernardes N、Ribeiro AS、Seruca R、Paredes J、Fialho AM。「治療不可能な乳がんを治療するための新しい候補薬としての細菌タンパク質アズリン」。第1回ポルトガル医用生体工学会議:1–4。土井:10.1109 /ENBENG.2011.6026047。ISBN 978-1-4577-0522-9。
^ Gao M、Zhou J、Su Z、Huang Y。「細菌のキュプレドキシンアズリンは細胞シグナル伝達ネットワークを乗っ取る:タンパク質間相互作用と癌治療」。タンパク質科学。26(12):2334–2341。土井:10.1002 /pro.3310。PMC 5699490。PMID 28960574。 ^ Warso MA、Richards JM、Mehta D、Christov K、Schaeffer C、Rae Bressler L、Yamada T、Majumdar D、Kennedy SA、Beattie CW、Das Gupta TK。「進行性固形腫瘍患者におけるp53ユビキチン化の非HDM2媒介ペプチド阻害剤であるp28のクラス初、ヒト初の第I相試験」。ブリティッシュジャーナルオブキャンサー。108(5):1061–70。土井:10.1038 /bjc.2013.74。PMC 3619084。PMID 23449360。 ^ Chaudhari A、Mahfouz M、Fialho AM、Yamada T、Granja AT、Zhu Y、Hashimoto W、Schlarb-Ridley B、Cho W、Das Gupta TK、Chakrabarty AM。「キュプレドキシンと癌の相互関係:アズリンとEphB2の結合、EphB2のチロシンリン酸化への干渉、および癌の増殖の阻害」。生化学。46(7):1799–810。土井:10.1021 / bi061661x。PMID 17249693。 “