BOK_(gene)
Bok(Bcl-2関連の卵巣キラー)は、多くの無脊椎動物や脊椎動物に見られるBcl-2ファミリーのタンパク質コード遺伝子です。それはアポトーシス、特別なタイプの細胞死を誘発します。現在、このプロセスにおけるBokの正確な機能は不明です。 BOK 識別子
エイリアス
BOK、BCL2L9、BOKL、BCL2関連の卵巣キラー、BCL2ファミリーアポトーシスレギュレーター、BCL2ファミリーアポトーシスレギュレーターBOK
外部ID
OMIM:605404 MGI:1858494 HomoloGene:9632 GeneCards:BOK
遺伝子の位置(ヒト) Chr。 2番染色体(ヒト)
バンド 2q37.3 始める
241,551,424 bp
終わり
241,574,131 bp
遺伝子の位置(マウス) Chr。 1番染色体(マウス)
バンド
1 | 1 D
始める
93,685,660 bp
終わり
93,695,764 bp
RNA発現パターン
その他の参照発現データ
遺伝子オントロジー
分子機能
• タンパク質二量体化活性• GO:0001948タンパク質結合• シグナル伝達受容体結合• ユビキチンタンパク質リガーゼ結合• タンパク質ホモ二量体化活性• タンパク質ヘテロ二量体化活性• BHドメイン結合
細胞成分
• 膜の不可欠な構成要素• ミトコンドリア• 核• 核外膜• 細胞質• ミトコンドリア内膜• エンドソーム• 小胞体• 小胞体膜• ゴルジ装置• 膜• 初期エンドソーム膜• ミトコンドリア膜• トランスゴルジネットワーク膜• シスゴルジネットワーク膜• エンドソーム膜のリサイクル• ミトコンドリア外膜
生物学的プロセス
• アポトーシスプロセスの調節• ニューロンアポトーシスプロセス• 男性の性腺発達• アポトーシスの実行段階の正の調節• オリゴデンドロサイト分化• 脳の発達• p53クラスメディエーターによる内因性アポトーシスシグナル伝達経路• 細胞集団増殖•に 関与するシステイン型エンドペプチダーゼ活性の活性化アポトーシスプロセス• アポトーシスプロセス• ミトコンドリアからのシトクロムcの放出• 分解アポトーシスの実行段階に関与する細胞成分• シトクロムcによってアポトーシス過程に関与するシステイン型エンドペプチダーゼ活性の活性化• オートファジーの調節• アポトーシスプロセスの正の調節• 負の調節ニューロンアポトーシスプロセスの• タンパク質複合オリゴマー• 細胞質カルシウムイオン濃度の調節• ミトコンドリア脱分極の負の調節• ネクロトーシスプロセスの負の調節• apoptに関与するミトコンドリア外膜透過化の負の調節 耳のシグナル伝達経路• アポトーシスシグナル伝達経路に関与ミトコンドリア外膜透過性の正の調節• 絨毛栄養膜細胞増殖の調節• 小胞体ストレス誘導性内因性アポトーシスのシグナル伝達経路の正の調節• PERK媒介小胞体ストレスの正の調節• 顆粒の規制細胞アポトーシスプロセス• 内因性アポトーシスのシグナル伝達経路の正の調節• 内因性アポトーシスのシグナル伝達経路のDNA損傷に応答した• リガンドの非存在下における外因性アポトーシスシグナル経路
出典:Amigo / QuickGO
オーソログ
種族
人間
ねずみ Entrez666 51800 Ensembl ENSG00000176720 ENSMUSG00000026278 UniProt Q9UMX3 O35425
RefSeq(mRNA)NM_032515 NM_016778
RefSeq(タンパク質)NP_115904 NP_058058
場所(UCSC)
Chr 2:241.55 – 241.57 Mb
Chr 1:93.69 – 93.7 Mb
PubMed検索
ウィキデータ
人間の表示/
マウスの表示/
コンテンツ
1 発見と相同性
2 プロモーターと遺伝子構造
3 スプライスバリアント
4 発現パターン
5 細胞内局在
6 規制
7 相互作用
8 ノックアウトマウス
9 参考文献
10 外部リンク
発見と相同性
1997年、タンパク質Bcl-2関連卵巣キラー(Bok)は、豊富な抗アポトーシスタンパク質であるMcl-1と相互作用するタンパク質のスクリーニングにおいて、ラット卵巣cDNAライブラリーを用いた酵母ツーハイブリッド実験で同定されました。 Bokの過剰発現はアポトーシスを誘導します。BakおよびBaxとの配列類似性が高いため、 BokはBcl-2タンパク質ファミリーのメンバーとして分類されます。 Bokのマウス同族体はMatador(Mtd)と呼ばれています。この名前は、肉屋または殺人者を意味するラテン語のマクターに由来しています。さらに、相同タンパク質はキイロショウジョウバエ(ミバエ)とヤケイ(ニワトリ)で発見されました。
プロモーターと遺伝子構造
ヒトBOKプロモーターは、E2F手転写因子ファミリーのメンバーの過剰発現によって活性化されます。通常、これらの転写因子はS期の促進に関与しているため、Bokの発現と細胞周期の進行との間に関連がある可能性が細胞周期によるBok発現のこの調節のために、Bokはストレス誘発性アポトーシスに対して成長中の細胞を感作することが提案されました。
Bok mRNAは、Bok-Lと呼ばれる213アミノ酸のタンパク質をコードする5つのエクソンで構成されています。このタンパク質は、4つのBcl-2相同性ドメイン(それぞれ略称BH1、BH2、BH3、BH4)とC末端膜貫通領域で構成されています(図1)。そのBH3ドメインには、多くのロイシン残基を含むストレッチが含まれています。これはBcl-2ファミリーのメンバーの間でユニークです。ロイシンリッチストレッチは核外輸送シグナルとして機能します。それはCrm1の核輸出によって認識されています。ロイシンリッチストレッチの変異は、Crm1のBokへの結合を損ないます。その結果、Bokは核に蓄積し、アポトーシスを引き起こします。
スプライスバリアント
選択的スプライシングにより、Bok mRNAはさまざまなBokタンパク質を生成します。図1は、さまざまなスプライスバリアントを模式的に示しています。全長BokはBok-Lと名付けられています。
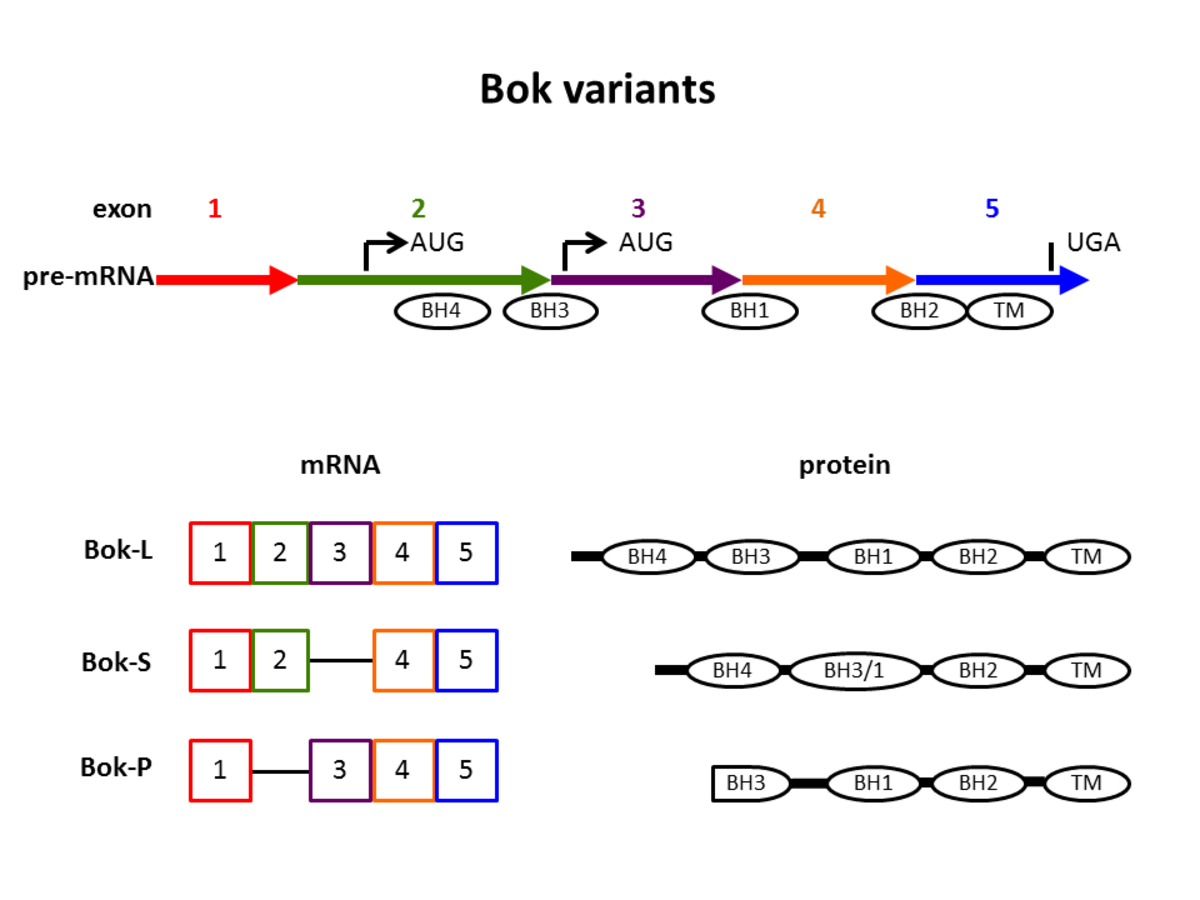
図1:スプライスバリアントはのボクのmRNAとなるタンパク質。
Bok mRNAは、5つのエクソンと2つの翻訳開始コドン(AUG)で構成されています。エクソンは、さまざまな色の矢印とボックスとして視覚化されます。楕円形は、Bcl-2相同性ドメイン(BH1、BH2、BH3、BH4)または膜貫通ドメイン(TM)をコードする配列を示します。Bok-Sバリアントでは、BH3ドメインが切り捨てられ、短縮されたBH1ドメインに融合されます。別の既知のバリアントであるBok-Pは、BH4ドメインを欠いており、切り捨てられたBH3ドメインを含んでいます。
短いバージョンのBok-Sにはエクソン3がありません。これにより、BH3ドメインとBH1ドメインが融合します。 BH3ドメインは、BokとMcl-1および他の分子との相互作用に関与しています。アポトーシスの誘導には欠かせません。 Bok-Sの発現は、ストレスシグナルへの即時の反応である可能性が抗アポトーシス分子の存在に関係なく、アポトーシスを誘導することが示されています。
Bok-Pと呼ばれる別のスプライスバリアントが子癇前症に苦しむ患者の胎盤組織で発見されました。Bok-Sはエクソン3を欠いていますが、Bok-Pはエクソン2を欠いています。この削除には、BH4ドメインとBH3ドメインの一部が含まれます。ボク-Pは中栄養膜細胞死の原因かもしれ子癇前症、危険な妊娠合併症。子癇前症では、典型的な変化が母体の腎臓で起こり、高血圧と尿中のタンパク質につながります。現在まで、この病状の原因と適切な治療法は発見され
発現パターン
ボクの遺伝子が活性化され、異なる組織においてタンパク質を産生します。マウスでは、卵巣、精巣、子宮でBokレベルの上昇が検出されました。それにもかかわらず、それは脳にも存在し、他のほとんどの組織には低レベルで存在します。しかしながら、Bok遺伝子の発現パターンは種によって異なります。
人間の場合、Bokはさまざまな組織に見られます。この遺伝子は、結腸、胃、精巣、胎盤、膵臓、卵巣、子宮で発現しています。さらに、成人組織と比較して、胎児組織ではより多くのBokが発現しています。したがって、Bokは開発に影響を与える可能性が
細胞内局在
Bokタンパク質の細胞内局在は物議を醸しています。で細胞を増殖、ボクが中に発見された核。アポトーシスが誘導されると、ミトコンドリア膜と密接に関連していることがわかりました。 一方、別のグループは、Bokが細胞質と核の間を往復しているのを発見した。彼らの実験では、核(ミトコンドリアではない)の局在の増加は、より強いアポトーシス活性と相関していた。
規制
アポトーシス促進性と抗アポトーシス性のBcl-2ファミリーメンバーの細胞比は、ミトコンドリアからのシトクロムcの放出やカスパーゼの活性化などの後期アポトーシスイベントに影響を与えることがわかりました。抗アポトーシスタンパク質と比較して高レベルのアポトーシス促進タンパク質は、アポトーシスを引き起こすようです。現在のモデルでは、アポトーシス促進タンパク質と抗アポトーシスタンパク質の間のヘテロダイマーの形成がアポトーシスの誘導を防ぎます。
相互作用
相互作用するパートナーへのBokの結合は、そのBH3ドメインによって媒介されているようです。スプライスバリアントBok-Sはこのドメインを欠いており、Bcl-2ファミリーの他のタンパク質とヘテロダイマーを形成することができません。
酵母ツーハイブリッド実験では、Bokが抗アポトーシスタンパク質Mcl-1、BHRF-1、およびBfl-1と相互作用することがわかりました。ただし、Bcl-2、Bcl-xL、Bcl-wなどの他の抗アポトーシスタンパク質との相互作用は検出できませんでした(1)。その後の研究は、Bokとアポトーシス促進性のBakまたはBaxとの相互作用を確認することを目的としていましたが、成功しませんでした。
したがって、Mcl-1などの抗アポトーシスタンパク質の共発現は、Bokの過剰発現によって誘導されるアポトーシスを抑制します。上記の結果と一致して、抗アポトーシスBcl-2の共発現はBok誘導アポトーシスを防止しません。
ノックアウトマウス
1997年の発見以来、Bokを特徴づけるためにいくつかの試みがなされてきました。胎児組織での発現レベルの増加により、科学者たちはボクの発達上の役割を予期していました。最近、Bokノックアウトマウスが作成されました。しかし、このマウスは発達上の欠陥や正常な出産を示しこの発見は、Bokの機能が関連するアポトーシス促進タンパク質BakおよびBaxの機能と重複しているように見えることを示しています。
特に細胞の発達において、Bokには他のいくつかの役割が提案されました。 アポトーシスの誘発におけるBokの作用は冗長であるように思われるため、BakおよびBaxの存在下でBokに特定の役割を割り当てることは困難です。それぞれBakとBokが不足している細胞、またはBaxとBokが不足している細胞の研究は、アポトーシスにおけるBokの役割をよりよく特徴づけるのに役立つ可能性がBokが重要な機能を発揮する場合、この機能は特定の状況、たとえば特定の細胞タイプ、ストレス状態に限定される可能性がしたがって、これらの側面をより詳細に評価して、Bokの生理学的および病理学的役割を分析する必要が
参考文献
^ GRCh38:Ensemblリリース89:ENSG00000176720 – Ensembl、2017年5月
^ GRCm38:Ensemblリリース89:ENSMUSG00000026278 – Ensembl、2017年5月
^ 「HumanPubMedリファレンス:」。米国国立バイオテクノロジー情報センター、米国国立医学図書館。
^ 「マウスPubMedリファレンス:」。米国国立バイオテクノロジー情報センター、米国国立医学図書館。
^ Hsu SY、Kaipia A、McGee E、Lomeli M、Hsueh AJ(1997年11月)。「Bokは、生殖組織での発現が制限されているアポトーシス促進性のBcl-2タンパク質であり、選択的な抗アポトーシス性のBcl-2ファミリーメンバーとヘテロ二量体化します」。アメリカ合衆国科学アカデミー紀要。94(23):12401–6。Bibcode:1997PNAS … 9412401H。土井:10.1073 /pnas.94.23.12401。PMC 24966。PMID 9356461。
^ Hsu SY、Hsueh AJ(1998年11月)。「BH3ドメインが切り詰められたBcl-2メンバーBokのスプライシングバリアントはアポトーシスを誘導しますが、invitroで抗アポトーシスBcl-2タンパク質と二量体化することはありません」。Journal of BiologicalChemistry。273(46):30139–46。土井:10.1074 /jbc.273.46.30139。PMID 9804769。
^ Soleymanlou N、Wu Y、Wang JX、Todros T、Ietta F、Jurisicova A、Post M、Caniggia I。「新しいMtdスプライスアイソフォームは子癇前症の栄養膜細胞死の原因です」。細胞死と分化。12(5):441–52。土井:10.1038 /sj.cdd.4401593。PMID 15775999。
^ Inohara N、Ekhterae D、Garcia I、Carrio R、Merino J、Merry A、Chen S、NúñezG(1998年4月)。「Mtd、新規Bcl-2ファミリーメンバーは、Bcl-2およびBcl-XLとのヘテロ二量体化がない場合にアポトーシスを活性化します」。Journal of BiologicalChemistry。273(15):8705–10。土井:10.1074 /jbc.273.15.8705。PMID 9535847。
^ Zhang H、Holzgreve W、De Geyter C。「Bcl-2ファミリーの進化的に保存されたBokタンパク質」。FEBSレター。480(2–3):311–3。土井:10.1016 / s0014-5793(00)01921-9。PMID 11034351。S2CID 19422343。
^ Rodriguez JM、Glozak MA、Ma Y、Cress WD。「Bok、Bcl-2関連の卵巣キラーは、細胞周期が調節されており、ストレス誘発性アポトーシスに敏感です」。Journal of BiologicalChemistry。281(32):22729–35。土井:10.1074 /jbc.M604705200。PMC 2134790。PMID 16772296。
^ Bartholomeusz G、Wu Y、Ali Seyed M、Xia W、Kwong KY、Hortobagyi G、Hung MC。「アポトーシス促進性のBcl-2ファミリーメンバーであるBokの核転座はアポトーシスを誘導します」。分子発癌。45(2):73–83。土井:10.1002 /mc.20156。PMID 16302269。S2CID 24230787。
^ Hsu SY、Hsueh AJ。「アポトーシスにおける組織特異的Bcl-2タンパク質パートナー:卵巣パラダイム」。生理学的レビュー。80(2):593–614。土井:10.1152 /physrev.2000.80.2.593。PMID 10747202。
^ Ke F、Voss A、Kerr JB、O’Reilly LA、Tai L、Echeverry N、Bouillet P、Strasser A、Kaufmann T。「BCL-2ファミリーのメンバーであるBOKは広く発現していますが、その喪失によるマウスへの影響はごくわずかです」。細胞死と分化。19(6):915–25。土井:10.1038 /cdd.2011.210。PMC 3354060。PMID 22281706。
^ Gao S、Fu W、DürrenbergerM、De Geyter C、Zhang H。「hBokの膜移行とオリゴマー化は、アポトーシス刺激とBnip3に応答して引き起こされます」(PDF)。細胞および分子生命科学。62(9):1015–24。土井:10.1007 / s00018-005-4543-3。PMID 15868100。S2CID 2947。
^ Ray JE、Garcia J、Jurisicova A、Caniggia I。「Mtd / Bokは揺れ動きます:アポトーシス促進性のMtd / Bokは、ヒト胎盤の発達中および子癇前症において栄養膜細胞の増殖を調節します」。細胞死と分化。17(5):846–59。土井:10.1038 /cdd.2009.167。PMID 19942931。
^ Suominen JS、Yan W、Toppari J、Kaipia A。「発育中および成体ラットの精巣におけるBcl-2関連卵巣キラー(Bok)mRNAの発現と調節」。内分泌学のヨーロッパジャーナル。145(6):771–8。土井:10.1530 /eje.0.1450771。PMID 11720903。
^ Soane L、Siegel ZT、Schuh RA、Fiskum G。「脳ミトコンドリアにおけるBcl-2ファミリータンパク質の出生後の発達調節」。神経科学研究ジャーナル。86(6):1267–76。土井:10.1002 /jnr.21584。PMC 2566804。PMID 18058945。
^ JääskeläinenM、Nieminen A、PökkyläRM、Kauppinen M、Liakka A、Heikinheimo M、Vaskivuo TE、KlefströmJ、Tapanainen JS。「ヒトの胎児および成人の卵巣における細胞死の調節-BokおよびBcl-X(L)の役割」(PDF)。分子および細胞内分泌学。330(1–2):17–24。土井:10.1016 /j.mce.2010.07.020。PMID 20673843。S2CID 1972679。
外部リンク
UCSC GenomeBrowserのヒトBOKゲノム位置とBOK遺伝子詳細ページ。”