BRAF_(gene)
BRAFは、B-Rafと呼ばれるタンパク質をコードするヒト遺伝子です。この遺伝子は、プロトオンコジーンB-Rafおよびv-Rafネズミ肉腫ウイルスオンコジーンホモログBとも呼ばれ、タンパク質は正式にはセリン/スレオニンタンパク質キナーゼB-Rafとして知られています。 BRAF 利用可能な構造 PDB オーソログ検索:PDBe RCSB
PDBIDコードのリスト
1UWH、1UWJ、2FB8、2L05、3C4C、3D4Q、3IDP、3II5、3NY5、3OG7、3PPJ、3PPK、3PRF、3PRI、3PSB、3PSD、3Q4C、3Q96、3SKC、3TV4、3TV6、4DBN、4E26、4E4X、4EHE、4EHG、4FC0、4FK3、4G9C、4G9R、4H58、4JVG、4KSP、4KSQ、4MBJ、4MNE、4MNF、4PP7、4WO5、5C9C、5CT7、4XV2、4XV1、4XV9、4XV3、4R5Y、5CSW、5CSX、4YHT、5J2R、5FD2、5HIE、5HID、5HI2、4CQE、5J18
識別子
エイリアス
BRAF、B-RAF1、BRAF1、NS7、RAFB1、B-Raf、B-Raf癌原遺伝子、セリン/スレオニンキナーゼ
外部ID
OMIM:164757 MGI:88190 HomoloGene:3197 GeneCards:BRAF
遺伝子の位置(ヒト) Chr。 7番染色体(ヒト)
バンド 7q34 始める
140,719,327 bp
終わり
140,924,928 bp
遺伝子の位置(マウス) Chr。 6番染色体(マウス)
バンド
6 B1 | 6 18.43 cM
始める
39,603,237 bp
終わり
39,725,463 bp
RNA発現パターン
その他の参照発現データ
遺伝子オントロジー
分子機能
• プロテインキナーゼ活性• カルシウムイオン結合• ヌクレオチド結合• トランスフェラーゼ活性• 金属イオン結合• キナーゼ活性• プロテインセリン/スレオニンキナーゼ活性• 小さなGTPase結合• GO:0001948タンパク質結合• 同一タンパク質結合• ATP結合• MAPキナーゼキナーゼキナーゼ活性• マイトジェン活性化プロテインキナーゼキナーゼ結合• タンパク質ヘテロ二量体化活性
細胞成分
• 細胞内膜結合オルガネラ• 膜• 核• 細胞内解剖学的構造• 細胞質• サイトゾル• 原形質膜• ミトコンドリア• ニューロン投射• 細胞体
生物学的プロセス
• カルシウムイオンに対する細胞応答• GO:0007243細胞内シグナル伝達• リン酸化• 膜へのタンパク質局在の確立• アポトーシス過程の負の調節• ペプチジル-セリンリン酸化の正の調節• タンパク質リン酸化• 動物器官の形態形成• シグナル伝達•の 負の調節シグナル伝達• グルコース貫通輸送の正の調節• ストレスに応答したトレハロース代謝• MAPKカスケード• 遺伝子発現の正の調節• 細胞分化• ERK1とERK2カスケードの正の調節• 骨髄前駆細胞の分化• 視覚的な学習• 線維芽細胞移動の負の調節• 甲状腺の発達• 体細胞幹細胞集団の維持• 薬物に対する細胞応答• 細胞集団増殖の調節• CD4陽性、アルファベータT細胞分化• 陽性T細胞選択• CD4陽性またはCD8陽性、アルファベータT細胞系統のコミットメント • ペプチドホルモンへの応答• ニューロンアポトーシス過程の負の調節• T細胞分化の調節• アルファ-ベータT細胞分化• 胸腺開発• 軸索再生の調節• 軸索再生の正の調節• axonogenesisの正の調節• T細胞受容体シグナル伝達経路• タンパク質ヘテロオリゴマー化• ストレスファイバーアセンブリの正の調節• cAMPへの応答• 長期シナプス増強• 頭部形態形成• 顔の発達• 基質接着依存性細胞拡散の正の調節• 神経成長因子刺激に対する細胞応答• シナプス小胞の負の調節エキソサイトーシス• 内皮細胞アポトーシスプロセスの負の調節
出典:Amigo / QuickGO
オーソログ
種族
人間
ねずみ Entrez673 109880 Ensembl ENSG00000157764 ENSMUSG00000002413 UniProt P15056 P28028
RefSeq(mRNA)
NM_004333 NM_001354609 NM_001374244 NM_001374258 NM_139294 RefSeq(タンパク質)
NP_004324 NP_001341538 NP_001361173 NP_001361187 NP_001365396
NP_001365397 NP_001365398 NP_001365399 NP_001365400 NP_001365401 NP_001365402 NP_001365403 NP_001365404 NP_647455 場所(UCSC)
Chr 7:140.72 – 140.92 Mb
Chr 6:39.6 – 39.73 Mb
PubMed検索
ウィキデータ
人間の表示/
マウスの表示/
B-Rafタンパク質は、細胞増殖の誘導に関与する細胞内のシグナルの送信に関与しています。2002年に、それはいくつかの人間の癌で突然変異していることが示されました。
他の特定の遺伝性BRAF変異は、先天性欠損症を引き起こします。
BRAF変異によって引き起こされる癌を治療する薬剤が開発されました。これらの薬剤のうちの2つ、ベムラフェニブとダブラフェニブは、後期黒色腫の治療のためにFDAによって承認されています。ベムラフェニブは、フラグメントベースの薬物発見から生まれた最初の承認された薬物でした。
コンテンツ
1 関数
2 構造
2.1 CR1 2.2 CR2 2.3 CR3
2.3.1 サブリージョン
3 酵素学
3.1 アクティベーション
3.1.1 CR1自動抑制の緩和
3.1.2 CR3ドメインのアクティブ化
3.2 触媒作用のメカニズム
3.2.1 ATP結合
3.2.2 リン酸化
3.3 阻害剤
3.3.1 ソラフェニブ
3.3.2 ベムラフェニブ
4 臨床的な意義
4.1 ミュータント
4.1.1 BRAF-V600E
4.2 BRAF阻害剤
5 相互作用
6 参考文献
7 参考文献
8 外部リンク
関数

アポトーシスに関与するシグナル伝達経路の概要
。B-RafのようなRafタンパク質の役割は中央に示されています。
B-Rafは、成長シグナル伝達プロテインキナーゼのRafキナーゼファミリーのメンバーです。このタンパク質は、細胞分裂、分化、および分泌に影響を与えるMAPキナーゼ/ ERKシグナル伝達経路を調節する役割を果たします。
構造
B-Rafは、766アミノ酸の調節されたシグナル伝達 セリン/スレオニン特異的プロテインキナーゼです。大まかに言えば、Rafキナーゼファミリーに特徴的な3つの保存ドメインで構成されています:保存領域1(CR1)、Ras – GTP結合自己調節ドメイン、保存領域2(CR2)、セリンリッチヒンジ領域、および保存領域3(CR3)、タンパク質基質上のコンセンサス配列をリン酸化する触媒プロテインキナーゼドメイン。 B-Rafは、その活性コンフォメーションにおいて、そのキナーゼドメインの水素結合および静電相互作用を介して二量体を形成します。
CR1
保存領域1はB-Rafのキナーゼドメイン(CR3)を自己阻害するため、B-Rafシグナル伝達は構成的ではなく調節されます。残基155–227 はRas結合ドメイン(RBD)を構成し、Ras-GTPのエフェクタードメインに結合してCR1を放出し、キナーゼ阻害を停止します。残基234〜280は、Ras結合後のB-Raf膜ドッキングに関与するホルボールエステル/ DAG結合ジンクフィンガーモチーフを含みます。
CR2
保存領域2(CR2)は、CR1とCR3を接続し、ヒンジとして機能する柔軟なリンカーを提供します。
CR3
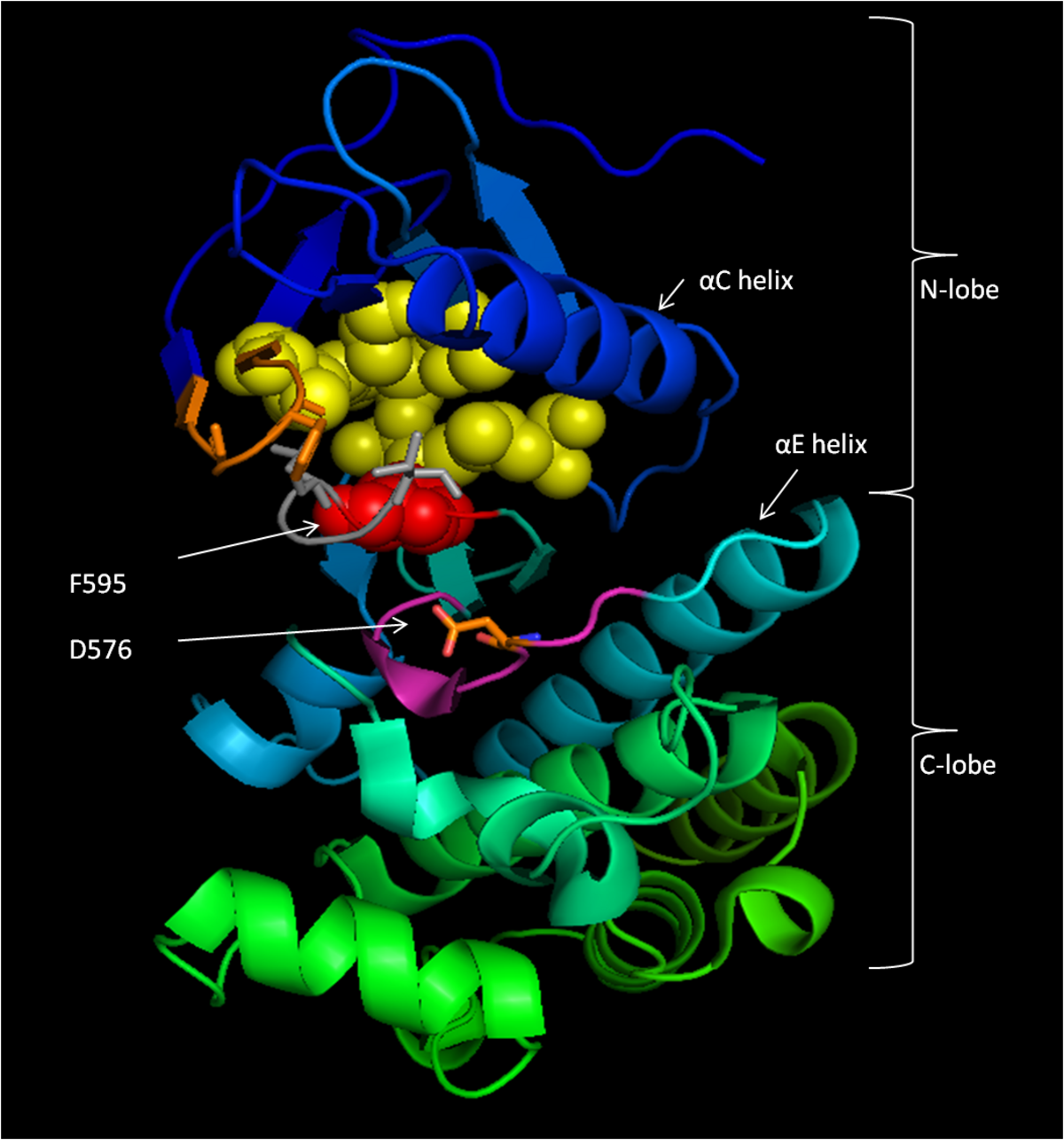
図1:B-Rafキナーゼ(CR3)ドメインの不活性コンフォメーション。不活性なキナーゼコンフォメーションを安定化する活性化ループ(灰色)残基とのPループ(オレンジ)疎水性相互作用が棒で示されています。F595(赤)は、ATPアデニンが結合する疎水性ポケット(黄色)をブロックします。D576(オレンジ)は、触媒ループ(マゼンタ)の一部として示されています。PDB ID1UWHから変更された図。
保存領域3(CR3)、残基457〜717、は、B-Rafの酵素キナーゼドメインを構成します。この大部分が保存された構造は二葉であり、短いヒンジ領域で接続されています。小さいNローブ(残基457–530)は主にATP結合に関与し、大きいCローブ(残基535–717)は基質タンパク質に結合します。活性部位は、2つのローブの間の裂け目であり、触媒作用のあるAsp 576残基は、この裂け目の内側に面したCローブ上に
サブリージョン
Pループ
B-RafのPループ(残基464〜471)は、酵素ATP結合中にATPの転移不可能なリン酸基を安定化します。具体的には、S 467、F 468、およびG 469バックボーンアミドがATPのβ-リン酸に水素結合して、分子を固定します。B-Raf機能モチーフは、ハンクスとハンターによって分析されたPKAのB-Rafキナーゼドメインに対する相同性を分析することによって決定されています。
ヌクレオチド結合ポケット
V 471、C 532、W 531、T 529、L 514、およびA 481は疎水性ポケットを形成し、その中にATPのアデニンがATP結合時にファンデルワールス引力を介して固定されます。
触媒ループ
残基574〜581は、ATPのγ-リン酸のB-Rafタンパク質基質への転移をサポートするキナーゼドメインのセクションを構成します。特に、D 576はプロトン受容体として作用し、基質のセリンまたはスレオニン残基上の求核性ヒドロキシル酸素を活性化し、塩基触媒作用によって媒介されるリン酸転移反応の発生を可能にします。
DFGモチーフ
D594、F595、およびG596は、非アクティブ状態とアクティブ状態の両方でB-Rafの機能の中心となるモチーフを構成します。不活性状態では、F595はヌクレオチド結合ポケットを占有し、ATPが入るのを防ぎ、酵素触媒作用の可能性を減らします。 アクティブ状態で、D594のキレート二価 マグネシウム カチオン転送用のγリン酸を配向、ATPのβ-及びγ-リン酸基を安定化させます。
アクティベーションループ
残基596〜600は、キナーゼの不活性コンフォメーションでPループと強い疎水性相互作用を形成し、活性化ループがリン酸化されるまでキナーゼを不活性状態にロックし、負電荷の存在下でこれらの相互作用を不安定にします。これにより、キナーゼの活性状態への移行が引き起こされます。具体的には、活性化ループのL597およびV600は、PループのG466、F468、およびV471と相互作用して、リン酸化されるまでキナーゼドメインを不活性に保ちます。
酵素学
B-Rafはセリン/スレオニン特異的プロテインキナーゼです。このように、のリン酸化を触媒するセリン及びトレオニンで残基をコンセンサス配列によって標的タンパク質上のATP得、ADP及び製品として、リン酸化タンパク質。これは高度に調節されたシグナル伝達 キナーゼであるため、B-Rafは酵素として活性化する前にまずRas – GTPに結合する必要が B-Rafが活性化されると、保存されたプロテインキナーゼ触媒コアは、二分子求核置換を介してATPのγ-リン酸基に対する活性化基質セリンまたはスレオニンヒドロキシル酸素原子の求核攻撃を促進することによりタンパク質基質をリン酸化します。
アクティベーション
CR1自動抑制の緩和
ヒトRafキナーゼのキナーゼ(CR3)ドメインは、2つのメカニズムによって阻害されます:それ自体の調節 Ras – GTP結合CR1ドメインによる自己阻害と、主要なセリンおよびチロシン残基の翻訳後リン酸化の欠如(c-RafのS338およびY341) )CR2ヒンジ領域。B-Rafの活性化中に、タンパク質の自己抑制性CR1ドメインは最初にRas-GTPのエフェクタードメインをCR1 Ras結合ドメイン(RBD)に結合し、ヒトRafキナーゼファミリーの他のメンバーと同様にキナーゼCR3ドメインを放出します。CR1-Ras相互作用は、CR1のシステインリッチサブドメイン(CRD)がRasおよび膜リン脂質に結合することで後で強化されます。 CR1を完全に放出して活性化する前にヒドロキシル含有CR2残基でリン酸化する必要があるA-RafおよびC -Rafとは異なり、B-RafはCR2S445で構成的にリン酸化されます。これにより、負に帯電したホスホセリンは、調節ドメインが結合解除されると、立体的および静電的相互作用を通じてCR1を即座に撃退し、CR3キナーゼドメインが基質タンパク質と相互作用できるようになります。
CR3ドメインのアクティブ化
自己抑制CR1調節ドメインが解放された後、B-RAFのCR3は、キナーゼドメインがそのに変更しなければならないATPアクティブ-結合配座異性体を、それが触媒することができる前に、タンパク質のリン酸化を。不活性コンフォメーションでは、DFGモチーフのF595が疎水性 アデニン結合ポケットをブロックし、活性化ループ残基がPループと疎水性相互作用を形成し、ATPがその結合部位にアクセスするのを防ぎます。活性化ループがリン酸化されると、リン酸の負電荷はPループの疎水性環境では不安定になります。その結果、活性化ループはコンフォメーションを変化させ、キナーゼドメインのCローブ全体に広がります。このプロセスでは、β6鎖との安定化βシート相互作用を形成します。一方、リン酸化された残基はK507に近づき、安定化塩橋を形成して活性化ループを所定の位置に固定します。DFGモチーフは、活性化ループとのコンフォメーションを変化させ、F595をアデニンヌクレオチド結合部位から出て、αCおよびαEヘリックスに隣接する疎水性ポケットに移動させます。一緒に、リン酸化の際のDFGと活性化ループの動きはATP結合部位を開きます。他のすべての基質結合ドメインと触媒ドメインはすでに配置されているため、活性化ループのリン酸化だけで連鎖反応を介してB-Rafのキナーゼドメインが活性化され、他の方法で調製された活性部位から蓋が本質的に除去されます。
触媒作用のメカニズム

図2:ATPのγ-リン酸基に対するセリン/スレオニン基質残基の塩基触媒求核攻撃。ステップ1:N581による二次マグネシウムイオンのキレート化とD576による基質Ser / Thrの脱プロトン化。ステップ2:ATPγ-リン酸に対する活性化基質ヒドロキシルの求核攻撃。ステップ3:マグネシウム複合体が分解し、D576が脱プロトン化します。ステップ4:製品のリリース。
セリンおよびスレオニン残基を脱離基としてADPで二分子置換することによりタンパク質のリン酸化を効果的に触媒するには、B-Rafは最初にATPに結合し、次にATPのγ-リン酸が移動するときに遷移状態を安定化する必要が
ATP結合
B-Rafは、アデニンヌクレオチドを非極性ポケットに固定し(黄色、図1)、水素結合とリン酸基との静電相互作用によって分子を配向させることにより、ATPに結合します。上記のPループおよびDFGモチーフのリン酸結合に加えて、K483およびE501は非転移性リン酸基の安定化において重要な役割を果たします。K483の第一級アミンの正電荷により、ATPが結合したときにATPα-およびβ-リン酸基の負電荷を安定させることができます。ATPが存在しない場合、E501カルボキシル基の負電荷がこの電荷のバランスを取ります。
リン酸化
ATPがB-Rafキナーゼドメインに結合すると、触媒ループのD576が基質のヒドロキシル基を活性化し、その求核性を高めてリン酸化反応を速度論的に駆動し、他の触媒ループ残基が遷移状態を安定化します(図2)。N581は、ATPに関連する2価のマグネシウムカチオンをキレート化して、分子を最適な置換に向けるのに役立ちます。K578は、ATPのγ-リン酸基の負電荷を中和するため、活性化されたser / thr基質残基は、リン酸を攻撃するときにそれほど多くの電子-電子反発を経験しません。リン酸基が転移した後、ADPと新しいリンタンパク質が放出されます。
阻害剤
構成的に活性なB-Raf変異体は一般に、細胞の増殖を過剰にシグナル伝達することによって癌を引き起こします(臨床的意義を参照)ので、B-Rafの阻害剤は、癌治療候補としてキナーゼドメインの不活性および活性コンフォメーションの両方に対して開発されました。
ソラフェニブ

図3:結合したBAY43-9006によって不活性コンフォメーションにロックされたB-Rafキナーゼドメイン。疎水性相互作用は、ATP結合部位にBAY43-9006を固定し、尿素基の水素結合はDFGモチーフのD594をトラップします。BAY43-9006トリフルオロメチル
フェニル環は、DFGモチーフと、立体障害を介したアクティブな会議者への活性化ループの移動をさらに禁止します。
BAY43-9006(ソラフェニブ、ネクサバール)は、原発性肝がんおよび腎臓がんの治療のためにFDAによって承認されたV600E変異型B-RafおよびC-Raf阻害剤です。Bay43-9006は、酵素を不活性型でロックすることにより、B-Rafキナーゼドメインを無効にします。阻害剤は、キナーゼドメインに対する高親和性を介してATP結合ポケットをブロックすることによってこれを達成します。次に、主要な活性化ループとDFGモチーフ残基を結合して、活性化ループとDFGモチーフのアクティブなコンフォメーションへの移動を停止します。最後に、トリフルオロメチルフェニル部分は、DFGモチーフと活性化ループのアクティブなコンフォメーション部位を立体的にブロックし、キナーゼドメインがコンフォメーションをシフトしてアクティブになることを不可能にします。
BAY43-9006の遠位ピリジル環は、キナーゼNローブの疎水性ヌクレオチド結合ポケットに固定され、W531、F583、およびF595と相互作用します。触媒ループF583およびDFGモチーフF595との疎水性相互作用は、これらの構造の不活性なコンフォメーションを安定化し、酵素活性化の可能性を減らします。K483、L514、およびT529と中央のフェニル環とのさらなる疎水性相互作用により、阻害剤に対するキナーゼドメインの親和性が高まります。F595とセンターリングの疎水性相互作用も、DFGコンフォメーションスイッチのエネルギー的好感度をさらに低下させます。最後に、BAY43-9006とキナーゼドメインの極性相互作用は、阻害剤に対する酵素親和性を高め、不活性コンフォメーションのDFG残基を安定化するというこの傾向を継続します。E501およびC532水素結合、尿素ながら、それぞれの阻害剤の基及びピリジル基、尿素 カルボニルはD594のバックボーンから水素結合受け入れアミド場所にDFGモチーフをロックする窒素を。
トリフルオロメチルフェニル部分は、キナーゼドメインがBAY43-9006に結合している場合、DFGモチーフと活性化ループがタンパク質のアクティブなコンフォメーション。
ベムラフェニブ

図4:ベムラフェニブ(右)とその前駆体であるPLX 4720(左)の構造、B-Rafキナーゼドメインの活性コンフォメーションの2つの阻害剤
PLX4032(ベムラフェニブ)は、後期黒色腫の治療のためにFDAによって承認されたV600変異型B-Raf阻害剤です。キナーゼドメインの不活性型を阻害するBAY43-9006とは異なり、ベムラフェニブはキナーゼの活性型「DFG-in」型を阻害し 、ATP結合部位にしっかりと固定します。ベムラフェニブは、活性型のキナーゼのみを阻害することにより、B-Rafが調節されていない細胞、通常は癌を引き起こす細胞の増殖を選択的に阻害します。
ベムラフェニブは、薬物動態上の理由でフェニル環が追加されている点で、その前駆体であるPLX4720とのみ異なるため、 PLX4720の作用機序はベムラフェニブと同等です。PLX4720は、そのアンカー領域である7-アザインドール二環式が、窒素原子が炭素に置き換えられた2つの場所でサイトを占める天然のアデニンとのみ異なるため、ATP結合サイトに対して良好な親和性を持っています。これにより、C532へのN7水素結合やQ530へのN1水素結合などの強力な分子間相互作用を維持できます。ATP結合疎水性ポケット(C532、W531、T529、L514、A481)内での優れた適合性により、結合親和性も向上します。水へのケトンリンカー水素結合と2番目の疎水性ポケット(A481、V482、K483、V471、I527、T529、L514、およびF583)へのジフルオロフェニルの適合は、全体として非常に高い結合親和性に寄与します。アクティブなRafへの選択的結合は、αCヘリックスのシフトによって作成されたRaf選択的ポケットに結合する末端プロピル基によって達成されます。キナーゼの活性コンフォメーションの選択性は、活性状態のD594のバックボーンペプチドNHとの水素結合によって安定化されるpH感受性の脱プロトン化スルホンアミド基によってさらに増加します。不活性状態では、阻害剤のスルホンアミド基が代わりにその残基の主鎖カルボニルと相互作用し、反発力を生み出します。したがって、ベムラフェニブはB-Rafのキナーゼドメインの活性状態に優先的に結合します。
臨床的な意義
BRAF遺伝子の変異は、2つの方法で病気を引き起こす可能性が第一に、突然変異は遺伝し、先天性欠損症を引き起こす可能性が第二に、突然変異は、癌遺伝子として、人生の後半に現れ、癌を引き起こす可能性が
この遺伝子の遺伝性変異は、心臓顔面皮膚症候群、心臓の欠陥、精神遅滞、独特の顔の外観を特徴とする病気を引き起こします。
この遺伝子の変異を含む、癌で発見された非ホジキンリンパ腫、大腸癌、悪性黒色腫、甲状腺乳頭癌、非小細胞肺癌、肺の腺癌、脳腫瘍などの神経膠芽腫および多形性xanthoastrocytomaなどの炎症Erdheim-Chester病のような病気。
BRAF遺伝子のV600E変異は、多くの研究で有毛細胞白血病に関連しており、不必要なMLH1シーケンシングを受ける患者の数を減らすためにリンチ症候群のスクリーニングに使用することが示唆されています。
ミュータント
ヒトの癌に関連するBRAF遺伝子の30以上の変異が同定されています。BRAF変異の頻度は、黒色腫や母斑の80%以上から、肺がんの1〜3%や結腸直腸がんの5%など、他の腫瘍の0〜18%まで、ヒトのがんでは大きく異なります。症例の90%で、チミンはヌクレオチド1799でアデニンに置換されています。これにより、活性化セグメントのコドン600(現在はV600Eと呼ばれます)でバリン(V)がグルタミン酸(E)に置換されます。人間の癌で発見されました。この突然変異は、甲状腺乳頭がん、結腸直腸がん、黒色腫、および非小細胞肺がんで広く観察されている。 BRAF-V600E変異は、ランゲルハンス細胞組織球症患者の57%に存在する。 V600E突然変異は、有毛細胞白血病の症例の100%でドライバー突然変異である可能性が高い。高頻度のBRAFV600E突然変異が、良性であるが局所浸潤性の歯原性腫瘍であるエナメル上皮腫で検出されている。 V600E突然変異は、シングルドライバー突然変異(遺伝的「喫煙銃」)として、乳頭頭蓋咽頭腫発症の特定の症例に関連している可能性もある。
発見された他の変異は、R461I、I462S、G463E、G463V、G465A、G465E、G465V、G468A、G468E、N580S、E585K、D593V、F594L、G595R、L596V、T598I、V599D、V599E、V599K、V599R、V600K、A727Vです。など、およびこれらの変異のほとんどは、2つの領域にクラスター化されています。Nローブのグリシンに富むPループと、活性化セグメントおよび隣接領域です。これらの突然変異は、活性化セグメントを不活性状態から活性状態に変化させます。たとえば、前に引用した論文では、Val599の脂肪族側鎖がPループ内のPhe467のフェニル環と相互作用することが報告されています。中型の疎水性Val側鎖を、ヒトの癌(Glu、Asp、Lys、またはArg)に見られるような、より大きく荷電した残基で置き換えると、DFGモチーフを不活性なコンフォメーションに維持する相互作用が不安定になると予想されるため、アクティブな位置へのアクティベーションセグメント。変異の種類に応じて、MEKに対するキナーゼ活性も変化する可能性がほとんどの変異体は、MEKに対する強化されたB-Rafキナーゼ活性を刺激します。ただし、いくつかの変異体は、MEKに対する活性は低下しますが、野生型C-RAFを活性化するコンフォメーションを採用し、ERKにシグナルを送るため、異なるメカニズムで作用します。
BRAF-V600E
BRAF V600Eは、プロテアソーム阻害剤に対する感受性の決定因子です。PLX4720によるBRAF-V600Eの遮断により、BRAF変異型結腸直腸癌細胞におけるカルフィルゾミブに対する感受性が逆転したため、プロテアソーム阻害剤に対する脆弱性は持続的なBRAFシグナル伝達に依存しています。プロテアソーム阻害は、BRAFV600E変異結腸直腸腫瘍における貴重なターゲティング戦略を表す可能性が
BRAF阻害剤
上記のように、BRAFはよく理解されている高収量のターゲットであるため、一部の製薬会社は抗がん剤として使用する変異B-rafタンパク質の特異的阻害剤を開発しています。 ベムラフェニブ(RG7204またはPLX4032)は、第III相臨床データに基づいて、2011年8月に転移性黒色腫の治療薬として米国食品医薬品局からゼルボラフとして認可されました。以前の最良の化学療法治療であるダカルバジンの7-12%と比較して、生存率の改善が見られ、治療に対する奏効率は53%でした。臨床試験では、B-Rafは転移性黒色腫患者の生存の可能性を高めた。薬の有効性が高いにもかかわらず、腫瘍の20%は依然として治療に対する耐性を示しています。マウスでは、腫瘍の20%が56日後に耐性になります。この耐性のメカニズムはまだ議論されているが、いくつかの仮説には、高濃度のベムラフェニブおよび成長シグナル伝達の上流のアップレギュレーションを補うためのB-Rafの過剰発現が含まれる。
より一般的なB-Raf阻害剤には、GDC-0879、PLX-4720、ソラフェニブ、ダブラフェニブ、LGX818が含まれます。
相互作用
BRAF(遺伝子)は以下と相互作用することが示されています: AKT1、 C-Raf、
HRAS、 および
YWHAB。
参考文献
^ GRCh38:Ensemblリリース89:ENSG00000157764 – Ensembl、2017年5月
^ GRCm38:Ensemblリリース89:ENSMUSG00000002413 – Ensembl、2017年5月
^ 「HumanPubMedリファレンス:」。米国国立バイオテクノロジー情報センター、米国国立医学図書館。
^ 「マウスPubMedリファレンス:」。米国国立バイオテクノロジー情報センター、米国国立医学図書館。
^ Sithanandam G、Kolch W、Duh FM、Rapp UR(1990年12月)。「ヒトB-rafcDNAの完全なコード配列とアイソザイム特異的抗体によるB-rafプロテインキナーゼの検出」。オンコジーン。5(12):1775–80。PMID 2284096。
^ Sithanandam G、Druck T、Cannizzaro LA、Leuzzi G、Huebner K、Rapp UR(1992年4月)。「B-rafとB-raf偽遺伝子は人間の7qに位置しています」。オンコジーン。7(4):795–9。PMID 1565476。
^ Davies H、Bignell GR、Cox C、Stephens P、Edkins S、Clegg S、他 。「ヒトの癌におけるBRAF遺伝子の変異」(PDF)。自然。417(6892):949–54。Bibcode:2002Natur.417..949D。土井:10.1038 / nature00766。PMID 12068308。S2CID 3071547。
^ 「FDAはZelboraf(ベムラフェニブ)およびBRAF変異陽性の転移性黒色腫(皮膚癌の致命的な形態)のコンパニオン診断を承認しました」(プレスリリース)。Genentech 。
^ Erlanson DA、Fesik SW、Hubbard RE、Jahnke W、Jhoti H。「20年後:創薬に対する断片の影響」。ネイチャーレビュー。創薬。15(9):605–619。土井:10.1038 /nrd.2016.109。PMID 27417849。S2CID 19634793。
^ “”Entrez Gene:BRAF””。
^ Daum G、Eisenmann-Tappe I、Fries HW、Troppmair J、Rapp UR(1994年11月)。「Rafキナーゼの詳細」。生化学の動向。19(11):474–80。土井:10.1016 / 0968-0004(94)90133-3。PMID 7855890。
^ Cutler RE、Stephens RM、Saracino MR、Morrison DK(1998年8月)。「Raf-1セリン/スレオニンキナーゼの自動調節」。アメリカ合衆国科学アカデミー紀要。95(16):9214–9。Bibcode:1998PNAS … 95.9214C。土井:10.1073 /pnas.95.16.9214。PMC 21318。PMID 9689060。
^ Bollag G、Tsai J、Zhang J、Zhang C、Ibrahim P、Nolop K、Hirth P。「ベムラフェニブ:BRAF変異がんに対して承認された最初の薬剤」。ネイチャーレビュー。創薬。11(11):873–86。土井:10.1038 / nrd3847。PMID 23060265。S2CID 9337155。
^ “”セリン/スレオニンタンパク質は、B-RAFキナーゼ”” 。
^ Morrison DK、Cutler RE(1997年4月)。「Raf-1規制の複雑さ」。細胞生物学における現在の意見。9(2):174–9。土井:10.1016 / S0955-0674(97)80060-9。PMID 9069260。
^ l Hanks SK、Hunter T(1995年5月)。「プロテインキナーゼ6.真核生物のプロテインキナーゼスーパーファミリー:キナーゼ(触媒)ドメインの構造と分類」。FASEBJournal。9(8):576–96。土井:10.1096 /fasebj.9.8.7768349。PMID 7768349。S2CID 21377422。
^ Wan PT、Garnett MJ、Roe SM、Lee S、Niculescu-Duvaz D、GoodVMなど。。がんゲノムプロジェクト。「B-RAFの発癌性変異によるRAF-ERKシグナル伝達経路の活性化のメカニズム」。セル。116(6):855–67。土井:10.1016 / S0092-8674(04)00215-6。PMID 15035987。S2CID 126161。
^ Tsai J、Lee JT、Wang W、Zhang J、Cho H、Mamo S、etal。。「強力な抗腫瘍活性を有する発癌性B-Rafキナーゼの選択的阻害剤の発見」。アメリカ合衆国科学アカデミー紀要。105(8):3041–6。Bibcode:2008PNAS..105.3041T。土井:10.1073 /pnas.0711741105。PMC 2268581。PMID 18287029。
^ Bollag G、Hirth P、Tsai J、Zhang J、Ibrahim PN、Cho H、etal。。「RAF阻害剤の臨床効果には、BRAF変異黒色腫における広範な標的遮断が必要です」。自然。467(7315):596–9。Bibcode:2010Natur.467..596B。土井:10.1038 / nature09454。PMC 2948082。PMID 20823850。
^ ハンクスSK、クインAM、ハンターT(1988年7月)。「プロテインキナーゼファミリー:触媒ドメインの保存された特徴と推定された系統発生」。科学。241(4861):42–52。Bibcode:1988Sci … 241 … 42H。土井:10.1126 /science.3291115。PMID 3291115。
^ ハンクスSK(1991年6月)。「真核生物のプロテインキナーゼ」。Curr。意見。構造体。Biol。1(3):369–383。土井:10.1016 / 0959-440X(91)90035-R。
^ ハンクスSK、クインAM(1991)。「プロテインキナーゼ触媒ドメイン配列データベース:一次構造の保存された特徴の同定およびファミリーメンバーの分類」。プロテインキナーゼ触媒ドメイン配列データベース:一次構造の保存された特徴の同定およびファミリーメンバーの分類。酵素学の方法。200。pp。38–62。土井:10.1016 / 0076-6879(91)00126-H。ISBN
9780121821012。PMID 1956325。
^ Mason CS、Springer CJ、Cooper RG、Superti-Furga G、Marshall CJ、Marais R(1999年4月)。「セリンとチロシンのリン酸化はRaf-1で協力しますが、B-Rafの活性化では協力しません」。EMBOジャーナル。18(8):2137–48。土井:10.1093 / emboj /18.8.2137。PMC 1171298。PMID 10205168。
^ Roberts A、Allanson J、Jadico SK、Kavamura MI、Noonan J、OpitzJMなど。。「心臓顔面皮膚症候群」。Journal of MedicalGenetics。43(11):833–42。土井:10.1136 /jmg.2006.042796。PMC 2563180。PMID 16825433。
^ Ewalt M、Nandula S、Phillips A、Alobeid B、Murty VV、Mansukhani MM、Bhagat G。「低悪性度および中悪性度のリンパ腫におけるBRAFV600E変異のリアルタイムPCRベースの分析により、有毛細胞白血病の頻繁な発生が確認されています」。血液腫瘍学。30(4):190–3。土井:10.1002 /hon.1023。PMID 22246856。S2CID 204843221。
^ Palomaki GE、McClain MR、Melillo S、Hampel HL、Thibodeau SN。「EGAPP補足エビデンスレビュー:リンチ症候群による罹患率と死亡率を減らすことを目的としたDNA検査戦略」。医学における遺伝学。11(1):42–65。土井:10.1097 /GIM.0b013e31818fa2db。PMC 2743613。PMID 19125127。
^ 難波H、中島M、林T、林田N、前田S、ロゴノビッチTI他 。「甲状腺乳頭がんにおけるホットスポットBRAF変異V599Eの臨床的意義」。Journal of Clinical Endocrinology andMetabolism。88(9):4393–7。土井:10.1210 /jc.2003-030305。PMID 12970315。
^ Tan YH、Liu Y、Eu KW、Ang PW、Li WQ、Salto-Tellez M、他 。「パイロシーケンシングによるBRAFV600E変異の検出」。病理学。40(3):295–8。土井:10.1080 / 00313020801911512。PMID 18428050。S2CID 32051681。
^ Li WQ、Kawakami K、Ruszkiewicz A、Bennett G、Moore J、Iacopetta B。「BRAF変異は、マイクロサテライト不安定性の状態とは無関係に、結腸直腸癌の特徴的な臨床的、病理学的および分子的特徴と関連しています」。分子がん。5(1):2。DOI:10.1186 / 1476-4598-5-2。PMC 1360090。PMID 16403224。
^ Benlloch S、PayáA、Alenda C、Bessa X、Andreu M、Jover R、他 。「結腸直腸癌におけるBRAFV600E変異の検出:自動配列決定とリアルタイム化学方法論の比較」。分子診断ジャーナル。8(5):540–3。土井:10.2353 /jmoldx.2006.060070。PMC 1876165。PMID 17065421。
^ ng G、Bell I、Crawley S、Gum J、Terdiman JP、Allen BA、他 。「BRAF変異は、メチル化されたhMLH1を伴う散発性結腸直腸癌に頻繁に存在しますが、遺伝性非ポリポーシス結腸直腸癌には存在しません」。臨床がん研究。10(1 Pt 1):191–5。土井:10.1158 /1078-0432.CCR-1118-3。PMID 14734469。
^ Gear H、Williams H、Kemp EG、Roberts F。「結膜黒色腫におけるBRAF変異」。調査眼科学および視覚科学。45(8):2484–8。土井:10.1167 /iovs.04-0093。PMID 15277467。
^ Maldonado JL、Fridlyand J、Patel H、Jain AN、Busam K、Kageshita T、他 。「原発性黒色腫におけるBRAF変異の決定因子」。国立がん研究所ジャーナル。95(24):1878–90。土井:10.1093 / jnci / djg123。PMID 14679157。
^ Puxeddu E、Moretti S、Elisei R、Romei C、Pascucci R、Martinelli M、他 。「BRAF(V599E)変異は、成人の散発性乳頭状甲状腺癌における主要な遺伝的事象です」。Journal of Clinical Endocrinology andMetabolism。89(5):2414–20。土井:10.1210 /jc.2003-031425。PMID 15126572。
^ Elisei R、Ugolini C、Viola D、Lupi C、Biagini A、Giannini R、他 。「BRAF(V600E)変異と甲状腺乳頭がん患者の転帰:15年間の追跡調査中央値」。Journal of Clinical Endocrinology andMetabolism。93(10):3943–9。土井:10.1210 /jc.2008-0607。PMID 18682506。
^ Badalian-Very G、Vergilio JA、Degar BA、Rodriguez-Galindo C、Rollins BJ。「ランゲルハンス細胞組織球症の理解における最近の進歩」。血液学の英国ジャーナル。156(2):163–72。土井:10.1111 /j.1365-2141.2011.08915.x。PMID 22017623。S2CID 34922416。
^ Tiacci E、Trifonov V、Schiavoni G、Holmes A、Kern W、MartelliMPなど。。「有毛細胞白血病におけるBRAF変異」。ニューイングランドジャーナルオブメディシン。364(24):2305–15。土井:10.1056 / NEJMoa1014209。PMC 3689585。PMID 21663470。レイサマリー–サイエンスアップデートブログ:Cancer ResearchUK。
^ Kurppa KJ、CatónJ、Morgan PR、RistimäkiA、Ruhin B、Kellokoski J、他 。「エナメル上皮腫における高頻度のBRAFV600E突然変異」。病理学ジャーナル。232(5):492–8。土井:10.1002 /path.4317。PMC 4255689。PMID 24374844。
^ Brastianos PK、Taylor-Weiner A、Manley PE、Jones RT、Dias-Santagata D、ThornerARなど。。「エクソームシーケンシングにより、乳頭頭蓋咽頭腫のBRAF変異が特定されます」。ネイチャージェネティクス。46(2):161–5。土井:10.1038 /ng.2868。PMC 3982316。PMID 24413733。レイサマリー–ブロードインスティテュート。
^ Zecchin D、Boscaro V、Medico E、Barault L、Martini M、ArenaSなど。。「BRAFV600Eはプロテアソーム阻害剤に対する感受性の決定因子です」(PDF)。分子がん治療薬。12(12):2950–61。土井:10.1158 /1535-7163.MCT-13-0243。PMID 24107445。S2CID 17012966。
^ King AJ、Patrick DR、Batorsky RS、Ho ML、Do HT、ZhangSYなど。。「キナーゼ阻害剤SB-590885による発癌性BRAFを発現する腫瘍の遺伝的治療指数の実証」。がん研究。66(23):11100–5。土井:10.1158 /0008-5472.CAN-06-2554。PMID 17145850。
^ Chapman PB、Hauschild A、Robert C、Haanen JB、Ascierto P、Larkin J、他 。BRIM-3研究グループ。「BRAFV600E変異を伴う黒色腫におけるベムラフェニブによる生存率の改善」。ニューイングランドジャーナルオブメディシン。364(26):2507–16。土井:10.1056 / NEJMoa1103782。PMC 3549296。PMID 21639808。
^ Das Thakur M、Salangsang F、Landman AS、Sellers WR、Pryer NK、LevesqueMPなど。。「黒色腫におけるベムラフェニブ耐性のモデル化は、薬剤耐性を未然に防ぐための戦略を明らかにします」。自然。494(7436):251–5。Bibcode:2013Natur.494..251D。土井:10.1038 / nature11814。PMC 3930354。PMID 23302800。
^ Nazarian R、Shi H、Wang Q、Kong X、Koya RC、Lee H、他 。「黒色腫は、RTKまたはN-RASのアップレギュレーションによるB-RAF(V600E)阻害に対する耐性を獲得します」。自然。468(7326):973–7。Bibcode:2010Natur.468..973N。土井:10.1038 / nature09626。PMC 3143360。PMID 21107323。
^ Guan KL、Figueroa C、Brtva TR、Zhu T、Taylor J、Barber TD、Vojtek AB。「Aktによるセリン/スレオニンキナーゼB-Rafの負の調節」。Journal of BiologicalChemistry。275(35):27354–9。土井:10.1074 /jbc.M004371200。PMID 10869359。
^ Weber CK、Slupsky JR、Kalmes HA、Rapp UR。「アクティブRasはcRafとBRafのヘテロ二量体化を誘導します」。がん研究。61(9):3595–8。PMID 11325826。
^ Stang S、Bottorff D、Stone JC(1997年6月)。「活性化されたRasとRaf-1のみの相互作用は、rat2細胞の形質転換に十分である可能性があります」。分子生物学および細胞生物学。17(6):3047–55。土井:10.1128 /MCB.17.6.3047。PMC 232157。PMID 9154803。
^ Reuter CW、Catling AD、Jelinek T、Weber MJ(1995年3月)。「NIH3T3線維芽細胞におけるMEK活性化の生化学的分析。B-Rafおよび他の活性化因子の同定」。Journal of BiologicalChemistry。270(13):7644–55。土井:10.1074 /jbc.270.13.7644。PMID 7706312。
^ Ewing RM、Chu P、Elisma F、Li H、Taylor P、Climie S、他 (2007)。「質量分析によるヒトタンパク質間相互作用の大規模マッピング」。分子システム生物学。3(1):89 DOI:10.1038 / msb4100134。PMC 1847948。PMID 17353931。
^ Qiu W、Zhuang S、von Lintig FC、Boss GR、Pilz RB。「cAMPおよび14-3-3タンパク質によるB-Rafキナーゼの細胞型特異的調節」。Journal of BiologicalChemistry。275(41):31921–9。土井:10.1074 /jbc.M003327200。PMID 10931830。
参考文献
ガーネットMJ、マレR。「有罪:B-RAFはヒトの癌遺伝子です」。がん細胞。6(4):313–9。土井:10.1016 /j.ccr.2004.09.022。PMID 15488754。
Quiros RM、Ding HG、Gattuso P、Prinz RA、Xu X。「未分化甲状腺癌の1つのサブセットがBRAFおよびp53突然変異による乳頭癌に由来するという証拠」。がん。103(11):2261–8。土井:10.1002 /cncr.21073。PMID 15880523。S2CID 29665029。
Karbowniczek M、Henske EP。「細胞分化におけるツベリンの役割:B-RafとMAPKは関与していますか?」ニューヨーク科学アカデミーの年報。1059(1):168–73。Bibcode:2005NYASA1059..168K。土井:10.1196 /annals.1339.045。PMID 16382052。S2CID 39146204。
Ciampi R、Nikiforov YE。「甲状腺腫瘍形成におけるRET / PTC再配列とBRAF変異」。内分泌学。148(3):936–41。土井:10.1210 /en.2006-0921。PMID 16946010。
エスピノサAV、ポルキアL、リンゲルMD。「甲状腺がんにおけるBRAFの標的化」。ブリティッシュジャーナルオブキャンサー。96(1):16–20。土井:10.1038 /sj.bjc.6603520。PMC 2360215。PMID 17179987。
Allanson JE、Roberts AE「ヌーナン症候群」。Pagon RA、Bird TD、DolanCRなど。(編)。GeneReviews 。シアトルWA:ワシントン大学、シアトル。
Rauen KA「心臓顔面皮膚症候群」。Pagon RA、Bird TD、Dolan CR(編)。GeneReviews 。シアトルWA:ワシントン大学、シアトル。
Gelb BD、Tartaglia M「レオパード症候群」。Pagon RA、Bird TD、Dolan CR(編)。GeneReviews 。シアトルWA:ワシントン大学、シアトル。
外部リンク
「BRAF遺伝子」。がん用語のNCI辞書。
BRAFの欠陥の発見—癌を引き起こすBRAF変異の発見に関するCancer Research UKのブログ投稿(ビデオを含む)
UCSC GenomeBrowserのヒトBRAFゲノム位置およびBRAF遺伝子詳細ページ。
![]()
には、米国国立がん研究所の文書
「Dictionary ofCancerTerms」のパブリックドメインの資料が組み込まれて います。 には、パブリックドメインにある米国国立医学図書館のテキストが組み込まれています。![]()
生物学ポータル”