C-Met_inhibitor
c-Met阻害剤は、肝細胞増殖因子/散乱因子(HGF / SF)の受容体であるc-Metチロシンキナーゼの酵素活性を阻害する小分子のクラスです。これらの阻害剤は、さまざまな種類の癌の治療に治療用途がある可能性が
多くのc-Met阻害剤は現在での臨床試験。クリゾチニブとカボザンチニブは米国FDAによって最初に承認されました。クリゾチニブは、局所進行性または転移性の患者の治療のために2011年に迅速承認を受けた非小細胞肺癌cabozantinibは、治療のために2012年に承認された一方で、甲状腺髄様がん 、それはまたの治療のための臨床試験を開始しました他のいくつかの種類のがん。
c-Metは、細胞の散乱、浸潤、アポトーシスおよび血管新生からの保護を刺激します。のc-Metは、レセプターチロシンキナーゼ、などの異なる癌、多種多様の原因となることができ、腎臓、胃、および小細胞肺癌、中枢神経系の腫瘍、ならびにいくつかの肉腫をの場合その活動は調節不全です。小分子阻害剤によるc-MetのATP結合部位の標的化は、チロシンキナーゼを阻害するための1つの戦略です。
コンテンツ
1 歴史
2 序章
3 構造と機能
4 発達
5 ATP競合小分子c-Met阻害剤
5.1 クラスI
5.1.1 クラスI阻害剤の構造活性相関
5.1.2 クラスI阻害剤の例
5.2 クラスII
5.2.1 クラスII阻害剤の構造活性相関
5.2.2 クラスII阻害剤の例
6 ATP非競合的小分子c-Met阻害剤
6.1 チバンチニブ
7 臨床試験と規制当局の承認
7.1 2010年現在の状況 7.2 2010年以降 7.3 他の阻害剤に関する研究
8 も参照してください
9 外部リンク
10 参考文献
歴史

図3.リン酸化されていないMetキナーゼドメインと複合体を形成して解決された最初の小分子Met阻害剤であるK252a。Metのヒンジとピラロカルバゾールの間に2つの重要な水素結合が形成されます。
1980年代初頭、METは形質転換癌遺伝子のタンパク質産物として説明されました。

図1.第1世代のc-Met阻害剤であるSU11274(赤い円のインドリン-2-オンコア)。

図2.第2世代のc-Met阻害剤であるPHA665752。
2002年にATP競合c-Met阻害剤を特定する最初の試みは、c-Metをブロックするスタウロスポリン様阻害剤であるK252aの発見につながりました。 K252aは、リン酸化されていないMETキナーゼドメインと複合体を形成して解決された最初の構造でした。ヒンジとピラロカルバゾールサブユニットの間に2つの水素結合を形成します。
その後、一連のより選択的なc-Met阻害剤が設計され、インドリン-2-オンコア(図1で囲まれている)がいくつかのキナーゼ阻害剤に存在しました。SU-11274は、インドリノンの5位での置換によって進化し、3,5-ジメチルピロール基を追加することによって進化しました。これは、より優れた効力と活性を持つ第2世代の阻害剤です。
この分野への関心は2007年以降急速に高まっており、2009年半ばには70を超える特許出願が公開されています。
癌治療の適切な標的としてc-Metが受け入れられた後、製薬業界では集中的な努力が払われてきました。リガンドがある場合とない場合の20の結晶構造が公開されており、2010年には12近くの小分子c-Met阻害剤が臨床的にテストされています。
序章
受容体型チロシンキナーゼ(RTK)は、多くの細胞内シグナル伝達経路を調節する上で重要な要素です。 Metチロシンキナーゼは肝細胞増殖因子(HGF)の受容体であり、散乱因子(SF)としても知られています。HGFは主に上皮細胞と間葉系細胞、例えば平滑筋細胞と線維芽細胞で発現します)。 HGFは通常、創傷治癒、肝臓の再生、胚および正常な哺乳類の発達、臓器の形態形成において活性が
c-Metの調節不全は、過剰発現、遺伝子増幅、突然変異、リガンド依存性の自己またはパラクリンループ、またはRTKの時期尚早な活性化が原因である可能性が これらすべての要因は、細胞の生存、細胞の増殖および運動性に影響を及ぼします。それらはまた、癌およびそれらを治療することを目的とする治療への抵抗をもたらす。異常なc-Met活性を有する患者は通常、予後不良、進行性疾患、転移の増加、および生存期間の短縮を示します。これが、HGF / c-METシグナル伝達経路の標的化が癌の治療として採用されていない理由であり 、いくつかの異なる治療アプローチが臨床的にテストされています。c-Metを標的とするためにさまざまなアプローチが使用されており、それぞれが抗体、ペプチドアゴニスト、 デコイ受容体、その他の生物学的阻害剤または小分子によるc-Metの活性化を調節する一連のステップの1つに焦点を当てています。分子阻害剤。
構造と機能

図4.いくつかのMet阻害の可能性の概略構造:抗体とアンタゴニスト(NK4など)は細胞外ドメインに結合します。細胞外ドメインのMetフラグメントもHGFに結合し、おとりのMetとして機能します。小分子阻害剤は細胞内Metキナーゼに結合します。Metの機能ドメイン:Pで囲まれた(リン酸基)、SS(ジスルフィド結合)、Semaドメイン(セマフォリン様)、PSI(プレキシン、セマフォリン、インテグリン)、IPTドメイン(免疫グロブリン様、プレキシン、転写因子)およびPTK(プロテインチロシンキナーゼ)。

図5.MetATP結合部位の地形的特徴。A:活性化ループ内のチロシン
、B:疎水性サブポケットC:中央疎水性領域、D:ヒンジ領域、E:疎水性サブポケット。
c-Met RTKサブファミリーは、他の多くのRTKファミリーとは構造が異なります。成熟型には、細胞外α鎖(50kDa)と膜貫通型β鎖(140kDa)があり、これらはジスルフィド結合で結合しています。ベータ鎖には、細胞内チロシンキナーゼドメインと、基質のドッキングと下流のシグナル伝達に不可欠なC末端のテールが含まれています。
HGFはMetの天然の高親和性リガンドです。 そのN末端領域はMetに結合し、受容体の二量体化と2つのチロシンの自己リン酸化がMetのキナーゼドメインの活性化ループ(Aループ)で起こります。
リン酸化はC末端に近いチロシンで起こり、アダプタータンパク質を動員して下流のシグナル伝達につながる多機能ドッキングサイトを作成します 。シグナル伝達は、Ras / Mapk、PI3K / Akt、c-Src、およびSTAT3 / 5によって媒介され、細胞増殖、アポトーシスの減少、細胞骨格機能の変化などが含まれます。
キナーゼドメインは通常、二葉構造で構成されており、葉は非常に保存されたATP結合部位に隣接するヒンジ領域に接続されています。
発達
PHA-66752とc-Metの共結晶構造からの情報を使用して、選択的阻害剤PF-2341066が設計されました。これは、と4 -フェノキシの一連の化合物を変更、2010年にフェーズI / II臨床試験を受けたアシル チオ尿素のc-Met活性、例えば有する化合物につながったグループキノリン。これは、アシル結合が末端アリール基に深い疎水性ポケットに浸透する能力を与え、化合物の効力を高めるという点で、c-Met阻害剤開発の進歩における重要なステップでした。AM7のように、ピリミドン基を持つアシルチオ尿素結合の代替物が発見されています。
AM7とSU11274は、比較的選択的なc-Met阻害剤を特定でき、その阻害がinvivoでの抗腫瘍効果につながるという最初の証拠を提供しました。AM7とSU11274のc-Metとの共結晶構造を比較すると、それらは異なることがわかりました。SU-11274は、ヒンジ領域に隣接してU字型のコンフォメーションで結合します。しかし、AM7はヒンジ領域からCヘリックスまでの領域にまたがる拡張コンフォメーションでc-Metに結合します。次に、疎水性のポケットに結合します。c-Metは、AM7との不活性な非リン酸化コンフォメーションを想定しており、キナーゼのリン酸化コンフォメーションと非リン酸化コンフォメーションの両方に結合できます。
これらの2つの異なるタイプの結合により、小分子Met阻害剤は2つのクラスに分類されています。クラスI(SU-11274のような)およびクラスII(AM7のような)。しかしながら、2つのクラスのどちらにも当てはまらない別のタイプの小分子阻害剤が他の2つとは異なる方法で結合する非競合的ATP阻害剤。
小分子阻害剤は選択性が異なり、非常に特異的であるか、または幅広い選択性を持っています。それらはATP競合または非競合のいずれかです。
ATP競合小分子c-Met阻害剤
2つのクラスは構造的に異なりますが、いくつかの特性を共有しています。どちらもキナーゼヒンジ領域で結合し(c-Met活性部位の異なる部分を占める)、ATPのプリンを模倣することを目的としています。。BMS-777607およびPF-02341066には2-アミノピリジン基があり、AMG-458にはキノリン基があり、MK-2461には三環系芳香族基が
クラスI
クラスI阻害剤は多くの異なる構造を持ち、比較的選択的でU字型のコンフォメーションを持ち、c-Metの活性化ループに結合します。
クラスI阻害剤の構造活性相関

図6.さまざまな置換グループを持つクラスIMet阻害剤のSAR。Arは、芳香族基を表します(この図では、左から右に、キノリン、アザインドール、ベンゾチアジド、ベンジル基(-OHなどのさまざまなR基を含む)およびメトキシフェニル))。Xは、コアとアリール基の間のリンカーを表します(左から右へ:メチル、ジフルオロメチル、メトキシ、アミノ、硫黄基)。R1は、C-7に追加されたさまざまなグループを表しています(上から下へ:N-結合型クロロフェノール、N-ヒドロキシエチルピラゾールおよびピラゾール)。テストされた類似体の多くの位置1、5、8、および9の原子は、CまたはN原子のいずれかでした。
一連のトリアゾロトリアジンが発見され、c-MET阻害剤として大きな期待が寄せられました。構造活性関係(SAR)は、トリアジン環に結合したアリール基と、ペンダントベンジル環に結合した適切な水素結合アクセプター(たとえば、ヒドロキシル基)の必要性を意味しますが、フェノールはヒンジバインダーとして機能するようです(Met1160を使用)そのトリアジンTyr1230と相互作用します。多くの類似した類似体が発見され、分析された。フェノール性ヒンジ結合要素がアリールアミノ-トリアゾロピリダジンまたはアリール-トリアゾロチアピリダジンに結合した、構造的に類似した一連のc-Met阻害剤。1原子リンカーは2原子リンカーよりも効率的であり、ベンジル位での置換は許容されるようでした。縮合した窒素密度の高いヘテロ芳香族化合物(トリアゾロピリダジン、トリアゾロピラジンおよびトリアゾロトリアジン)に結合した複素環式ヒンジ結合元素(キノリン、ピリジン、アザインドール)を有する化合物が記載されている。詳細については、図4を参照して
クラスI阻害剤の例
ジフルオロメチルリンカーと生物学的に利用可能なキノリン基を含むJNJ-38877605は、2010年に進行性および難治性の固形腫瘍を対象とした第I相の臨床試験を受けていました。
ATP競合性で非常に選択的な化合物であるPF-04217903は、トリアゾロピラジンのC-7につながれたN-ヒドロキシエチルピラゾール基を持っています。2010年に第I相臨床試験が行われていました。
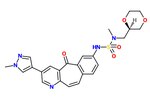
図7.ユニークなc-Met阻害剤であるMK2461
強力なc-Met阻害活性を持つユニークなキナーゼ阻害剤足場MK-2461のSARが調査されました。ピリジン窒素は阻害活性に必要であり、中心環の飽和により効力が低下します。分子の平面性は、最大の効力に不可欠であることが証明されています。環状エーテルは、許容できる細胞ベースの活性と薬物動態特性のバランスを取ります。次の要素は、最適化プロセスの鍵となると考えられています。
1)疎水性のパッキングと平面性を最大化するかのように、7位のアリール基
2)スルホンアミド基の添加時のタイトなSARおよび
3)溶媒に曝されたグループの比較的平坦なSAR。
多くの場合、c-Metの発癌性変異は、小分子阻害剤に対する耐性を引き起こします。したがって、MK-2461アナログは、さまざまなc-Met変異体に対してテストされましたが、それらに対してそれほど強力ではないことが証明されました。これは、c-Metの調節不全によって引き起こされる腫瘍の治療として分子に大きな利点をもたらします。 MK-2461は、2010年に第I相用量漸増試験を受けていました。
クラスII
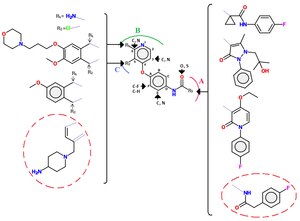
図8.クラスIIMet阻害剤の一般的な足場。テストされた類似体の多くの位置F、E、6、および3の原子は、C、CF、またはNグループのいずれかでした。アミドのO原子をS原子の代わりに使用することができます。R基は、METに対してさまざまな置換基(上から下への左側:アミド、塩素、アリールオキシキノリン基、メトキシフェニル、および末端アミン基を持つピロロトリアジン)でテストされたグループの一部を表します。右側から上から下へ:シクロプロピル基を有するフルオロフェニルマロンアミド、ヒドロキシメチルフェニルピラゾロン、エトキシフルオロフェニルピリドンおよびフルオロフェニルオキサルアミド)A:R3基はc-METの疎水性ポケットに留まり、B:ピリジン基はヒンジ領域に結合し、C: R2基は通常、ATPのリボースが通常結合するリボースポケットに結合します。
クラスII阻害剤は通常、クラスIの阻害剤ほど選択的ではありません。 尿素基は、環状または非環状のいずれかで、クラスII阻害剤の一般的な特徴でもクラスIIの阻害剤には多くの異なる分子が含まれており、その一般的な足場を図4に示します。
クラスII阻害剤の構造活性相関
アシルチオ尿素結合を有する一連のキノリンc-Met阻害剤が調査されてきた。代替のヒンジ結合基(例えば、キノリン基の置換)、チオ尿素結合(例えば、マロンアミド、オキサラミド、ピラゾロン)の置換、および非環式アシルチオ尿素構造フラグメントの様々な芳香族複素環による拘束を伴う複数の一連の類似体が見出された。さらなる改良には、フッ素原子によるペンダントフェニル環のp位のブロッキングが含まれていました。 c-MetとクラスIIの小分子(赤い円でマーク)の間の相互作用の例は次のとおりです。c-Metの足場は、3つの重要な水素結合によってATPポケットに留まり、末端アミンは相互作用します。リボース(ATPの)ポケット、端末4-フルオロフェニル基が疎水性ポケットに配向し、ピロロトリアジンは、ヒンジ結合基の役割を果たしています。
クラスII阻害剤の例
第II相臨床試験では、GSK 1363089(XL880、フォレチニブ)の忍容性は良好でした。それは、乳頭状腎癌および低分化胃癌の患者にわずかな退行または安定した疾患をもたらしました。
AMG 458は強力な小分子c-MET阻害剤であり、55種類のキナーゼのパネル全体でc-METに対して100倍以上の選択性があることが証明されています。また、AMG 458は種間で100%生物学的に利用可能であり、固有の半減期は高等哺乳動物で増加しました。
ATP非競合的小分子c-Met阻害剤編集
チバンチニブ

c-Met阻害剤であるチバンチニブ(ARQ197)
は、記事Tivantinibと矛盾しているようです。 リンクされたトークページのディスカッションをご覧
チバンチニブ(ARQ197)は、選択的で経口投与可能な 臨床的に進歩した低分子量で、忍容性の高いc-MET阻害剤であり、現在非小細胞肺がん患者を対象とした第III相臨床試験。 ARQ197は非ATP競合c-MET自己リン酸化阻害剤であり、キナーゼの非リン酸化コンフォメーションに対して高い選択性を示します。 チバンチニブは、主要な触媒残基間の相互作用を遮断します。 c-Metキナーゼドメインと複合体を形成したチバンチニブの構造は、阻害剤が公開されているキナーゼ構造とは異なるコンフォメーションに結合することを示しています。チバンチニブは、N-ローブとC-ローブの間のキナーゼの不活性型を選択的に標的とすることにより、c-Metの自己活性化を強力に阻害し、ATP結合部位を占有します。
臨床試験と規制当局の承認編集
2010年現在の状況
MetとHGFの発見以来、多くの研究の関心が癌におけるそれらの役割に集中してきました。Met経路は、ヒトの癌で最も頻繁に調節不全になる経路の1つです。結合モードと構造設計の理解が深まると、他のタンパク質相互作用と結合ポケットの使用に近づき、代替構造と最適化されたプロファイルを持つ阻害剤が作成されます。
表1.臨床試験における小分子c-Met阻害剤の例(2010年)。

SND:構造は開示されRON:Recepteur d’origine nantais ALK:
未分化リンパ腫キナーゼ;
VEGFR2:血管内皮増殖因子受容体2; MiT:小眼球症転写因子腫瘍; PDAC:膵管腺癌; NSCLC:非小細胞肺癌; HCC:肝細胞癌; MTC:甲状腺髄様がん; GBM:膠芽腫; RCC:腎細胞がん; HNSCC:頭頸部扁平上皮癌; IND:治験中の新薬。
2010のようなダースのMet経路阻害剤上、高度に選択から多標的までの範囲のキナーゼ選択性プロファイルを変化させると、臨床で研究されていると、良好な進歩が達成された (参照表1)。(例:XL184(カボザンチニブ)、XL880、ARQ197)
他の治療薬と一緒にc-Met阻害剤を使用することは、潜在的な耐性を克服するため、および全体的な臨床的利益を改善するために重要である可能性がメット経路阻害剤を含む他の治療と組み合わせて使用されるかもしれない化学療法- 、ラジオ-または免疫療法ならびに異なるmet経路阻害剤、f.ex. HGFおよびMetの生物学的拮抗薬またはHGFおよびMETに対する抗体を使用します。それでも、蓄積された毒性および他の薬物との相互作用のリスクは残っています。
2010年以降
2011年、PF-02341066(現在はクリゾチニブと呼ばれています)は、一部の非小細胞肺がんについて米国FDAによって承認されました。
2012年にXL184 /カボザンチニブは甲状腺髄様がんの治療についてFDAの承認を取得し、2016年には腎臓がんの治療についてFDAとEUの承認を取得しました。
あなたはそれに追加することによって助けることができます
他の阻害剤に関する研究
テポチニブ、(MSC 2156119J)、
肺がんに関する第II相臨床試験の結果を報告しています。 Tepotinibが付与された画期的な治療米国による指定を食品医薬品局(FDA) 9月2019年に(FDA)これは、許可されたオーファンドラッグの9月2020年には2019年11月に日本での指定を、そしてオーストラリアで
も参照してください
間葉上皮転換
肝細胞増殖因子 K252a 上皮間葉転換
c-会った
外部リンク
肝細胞増殖因子/ Metシグナル伝達経路を標的とする実験的癌治療
参考文献
^ Liu X、Newton RC、Scherle PA。「c-MET経路阻害剤の開発」。Expert Opin InvestigDrugs。20(9):1225–41。土井:10.1517 /13543784.2011.600687。PMID 21740293。S2CID 24415851。
^ Kazandjian、D; etal。。「FDA承認の概要:未分化リンパ腫キナーゼ再構成を伴う転移性非小細胞肺癌の治療のためのクリゾチニブ」。オンコロジスト。19(10):e5-11。土井:10.1634 /theoncologist.2014-0241。PMC 4201002。PMID 25170012。 ^ 「FDAはCometrikがまれなタイプの甲状腺癌を治療することを承認します」。
^ Comoglio PM、Giordano S、Trusolino L。「MET阻害剤の薬剤開発:腫瘍遺伝子中毒と便宜を目標とする」。ネイチャーレビュードラッグディスカバリー。7(6):504–16。土井:10.1038 / nrd2530。PMID 18511928。S2CID 24601127。 ^ Maulik G、Shrikhande A、Kijima T、Ma PC、Morrison PT、Salgia R。「発癌および治療的阻害の可能性における肝細胞成長因子受容体c-Metの役割」。サイトカイン成長因子改訂。13(1):41–59。土井:10.1016 / S1359-6101(01)00029-6。PMID 11750879。 ^ Davis IJ、McFadden AW、Zhang Y、Coxon A、Burges TL、Wagner AJ、Fisher DE。「明細胞肉腫の治療標的としての受容体型チロシンキナーゼc-Metとそのリガンドである肝細胞増殖因子の同定」。CancerRes。70(2):639–45。土井:10.1158 /0008-5472.CAN-09-1121。PMC 2807989。PMID 20068147。 ^ Porter J、Lumb S、Franklin RJ、Gascon-Simorte JM、Calmiano M、Riche KL、Lallemand B、Keyaerts J、Edwards H、Maloney A、Delgado J、King L、Foley A、Lecomte F、Reuberson J、Meier C 、Batchelor M。「c-Metキナーゼの新規阻害剤としての4-アザインドールの発見」。Bioorg。Med。化学。Lett。19(10):2780–4。土井:10.1016 /j.bmcl.2009.03.110。PMID 19369077。 ^ Schiering N、Knapp S、Marconi M、Flocco MM、Cui J、Perego R、Rusconi L、Cristiani C、「肝細胞増殖因子受容体c-Metのチロシンキナーゼドメインの結晶構造とその微生物アルカロイドK-252aとの複合体」、Proc。国立 Acad。科学。USA、100(22):12654–12659、Bibcode:2003PNAS..10012654S、doi:10.1073 / pnas.1734128100、PMC 240673、PMID 14559966 ^ Sattler M、Pride YB、Ma P、Gramlich JL、Chu SC、Quinnan LA、Shirazian S、Liang CX、Podar K、Christensen JG、Salgia R、「新しい小分子Met阻害剤はアポトーシスを誘導します発癌性TPR-METチロシンキナーゼによって形質転換された細胞」、Cancer Research、63(17):5462–5469、PMID 14500382
^ Porter、J、「小分子c-Metキナーゼ阻害剤:最近の特許のレビュー」、治療に関する専門家の意見特許、20(2):159–177、doi:10.1517 / 13543770903514137、PMID 20100000、S2CID 22743228 ^ Christensen JG、Schreck R、Burrows J、Kuruganti P、Chan E、Le P、Chen J、Wang XY、Ruslim L、Blake R、Lipson KE、Ramphal J、Do S、Cui JR、Cherrington JM 、Mendel DB、「c-Metキナーゼの選択的小分子阻害剤はinvitroでc-Met依存性表現型を阻害し、invivoで細胞減少性抗腫瘍活性を示す」、Cancer Research、63(21):7345–55、PMID 14612533
^ Underiner TL、Herbertz T、Miknyoczki SJ、「小分子c-Met阻害剤の発見:臨床の進化とプロファイル候補者」、医薬品化学における抗がん剤、10(1):7–27、doi:10.2174 / 1871520611009010007、PMID 20015007 ^ Sattler M、Salgia R、「治療標的としてのMet軸」、Cancer Therapeuticsの最新情報、3(3):109–118、doi:10.1016 / j.uct.2009.01.001、PMC 2847295、PMID 20368753 ^ クリステンセンJG; バロウズJ; Salgia R.、「c-Metはヒトの癌の標的であり、治療的介入の阻害剤の特性評価」、Cancer Letters、225(1):1–26、doi:10.1016 / j.canlet.2004.09.044、PMID 15922853 ^ Knudsen BS、Woude GV、「薬物によるc-MET依存性癌のシャワー」、遺伝学および開発における現在の意見、18(1):87–96、doi:10.1016 / j.gde.2008.02.001、PMID 18406132 ^ ドナルドP.ボタロ; ミーガンピーチ; マレックニクラウス; テレンスバーク、JR。Gagani Athauda; サラ・チョイク; アレッシオギベリーノ; ネリータン; Zhen-Dan Shi、「肝細胞成長因子受容体c-Metシグナル伝達の阻害のための組成物および方法」、米国特許出願公開
^ Liu XD、Newton RC、Scherle PA、「癌治療のためのc-MET経路阻害剤の開発:進歩と課題」、分子医学の動向、16(1):37–45 、doi:10.1016 / j.molmed.2009.11.005、PMID 20031486 ^ Kung PP、Funk L、Meng J、Alton G、Padrique E、Mroczkowski B、「キノリン含有c-Met阻害剤の構造活性相関」、European Journal of Medicinal Chemistry、43(8):1321– 1329、doi:10.1016 / j.ejmech.2007.08.011、PMID 17964000 ^ ベロンSF; カプラン-レフコP; ヤンYJ; 張YH; 森口J; レックスK; ジョンソンCW; ローズPE; 長いAM; オコナーAB; Gu Y; コクソンA; キムTS; タスカーA; バージェスTL; Dussault I、「新しい結合モードを持つc-Met阻害剤は、いくつかの遺伝性乳頭状腎細胞癌関連変異に対して活性を示す」、Journal of Biological Chemistry、283(5):2675–2683、doi:10.1074 / jbc。 M705774200、PMID 18055465 ^ Dussault I、Bellon SF、「概念から現実へ:癌治療のためのc-MetおよびRON受容体チロシンキナーゼ阻害剤への長い道のり」、医薬品化学における抗癌剤、9( 2):221–229、doi:10.2174 / 187152009787313792、PMID 19199866 ^ Eathiraj S、Palma R、Volckova E、Hirschi M、France DS、Ashwell MA、Chan TC、「ヒトの阻害メカニズムを特徴とするプロテインキナーゼ阻害の新しいモードの発見間葉上皮移行因子(c-Met)タンパク質のARQによる自己リン酸化197 “、Journal of Biological Chemistry、286(23):20666–20676、doi:10.1074 / jbc.M110.213801、PMC 3121448、PMID 21454604 ^ Allen JV、Bardelle C、Blades K、Buttar D、Chapman L、Colclough N、Dossetter AG、Garner AP、Girdwood A、Lambert C、Leash AG、Law B、Major J、Plant H、Slater AM、 「指示されたスクリーニングアプローチによるc-Met受容体チロシンキナーゼ阻害剤としてのベンズアニリドの発見」、Bioorganic&Medicinal Chemistry Letters、21(18):5224-5229、doi:10.1016 / j.bmcl.2011.07.047、PMID 21835616 ^ Katz JD、Jewell JP、Guerin DJ、Lim J、Dinsmore CJ、Deshmukh SV、Pan BS、Marshall CG、Lu W、Altman MD、Dahlberg WK、Davis L、Falcone D、Gabarda AE、Hang GZ、Hatch H、Holmes R、Kunii K、Lumb KJ、Lutterbach B、Mathvink R、Nazef N、Patel SB、Qu XL、Reilly JF、Rickert KW、Rosenstein C、Soisson SM、Spencer KB、Szewczak AA、Walker D、Wang WX、 Young J、Zeng QW、「5H-ベンゾシクロヘプタピリジン-5-オン(MK-2461)阻害剤のc-Metキナーゼの治療のための発見Cancer」、Journal of Medicinal Chemistry、54(12):4092–4108、doi:10.1021 / jm200112k、PMID 21608528 ^ 局所進行性または転移性非小細胞肺癌(NSCLC)の被験者におけるゲフィチニブを伴うテポチニブ(洞察)
^ METエクソン14スキップ変異を伴う進行性肺腺癌におけるc-Met阻害剤テポチニブの第II相試験。2017年 ^ 「テポチニブ画期的治療」。Merck KGaA、ダルムシュタット、ドイツ(プレスリリース)。
^ 「希少疾病用医薬品の指定」。Merck KGaA、ダルムシュタット、ドイツ(プレスリリース)。”