DAPI
DAPI(「DAPPY」、/ ˈdæpiː /と発音)、または4 ‘、6-ジアミジノ-2-フェニルインドールは、DNAのアデニン(チミンに富む領域)に強く結合する蛍光 染色剤です。蛍光顕微鏡で広く使用されています。DAPIは無傷の細胞膜を通過できるため、生細胞と固定細胞の両方を染色するために使用できますが、生細胞では膜を通過する効率が低く、膜の生存率のマーカーとなります。 DAPI 名前 IUPAC名 2-(4-アミジノフェニル)-1H- インドール-6-カルボキサミジン
他の名前
4 ‘、6-ジアミジノ-2-フェニルインドール
識別子
CAS番号
28718-90-3 Y
3Dモデル(JSmol)
インタラクティブ画像
インタラクティブ画像 ChEBI CHEBI:51231 YChEMBL ChEMBL48217 Y ChemSpider 2848 Y PubChem CID 2954
CompToxダッシュボードEPA) DTXSID50963757 InChI
InChI = 1S / C16H15N5 / c17-15(18)10-3-1-9(2-4-10)13-7-11-5-6-12(16(19)20)8-14(11) 21-13 / h1-8,21H、(H3,17,18)(H3,19,20) Y キー:FWBHETKCLVMNFS-UHFFFAOYSA-N Y InChI = 1 / C16H15N5 / c17-15(18)10-3-1-9(2-4-10)13-7-11-5-6-12(16(19)20)8-14(11) 21-13 / h1-8,21H、(H3,17,18)(H3,19,20)
キー:FWBHETKCLVMNFS-UHFFFAOYAH SMILES = C(N)c3ccc(c2cc1ccc(cc1 2)C(= )N)cc3
/ N = C(/ c1ccc(cc1)c2cc3ccc(cc3 2)/ C(= N / )/ N) N
プロパティ
化学式
C 16 H 15 N 5
モル質量 277.331g ・mol -1
特に明記されていない限り、データは
標準状態(25°C 、100 kPa)の材料について示されています。
Y 確認します YN
インフォボックスの参照
コンテンツ
1 歴史
2 蛍光特性
3 吸収および蛍光特性のモデリング
4 生細胞と毒性
5 代替案
6 参考文献
7 も参照してください
歴史
DAPIは、トリパノソーマ症を治療するための薬剤の検索の一環として、1971年にオットーダンの研究室で最初に合成されました。薬物としては成功しませんでしたが、さらなる調査により、DNAに強く結合し、結合するとより蛍光性になることが示されました。これは、1975年に超遠心分離でミトコンドリアDNAを同定する際の使用につながりました。これは、蛍光DNA染色としてのDAPIの最初の記録された使用です。
DNAに結合したときの強い蛍光により、蛍光顕微鏡用のDNAの蛍光染色にDAPIが急速に採用されました。植物、後生動物、細菌の細胞やウイルス粒子のDNAを検出するための使用は、1970年代後半に実証され、細胞内のDNAの定量的染色は1977年に実証されました。フローサイトメトリーのDNA染色としてのDAPIの使用もこの頃に実証されました。 。
蛍光特性
二本鎖DNAに結合すると、DAPIの吸収極大は波長358 nm(紫外線)で、発光極大は461 nm(青)になります。したがって、蛍光顕微鏡の場合、DAPIは紫外線で励起され、青/シアンのフィルターで検出されます。発光ピークはかなり広いです。 DAPIはRNAにも結合しますが、蛍光はそれほど強くありません。RNAに結合すると、その発光は約500nmにシフトします。
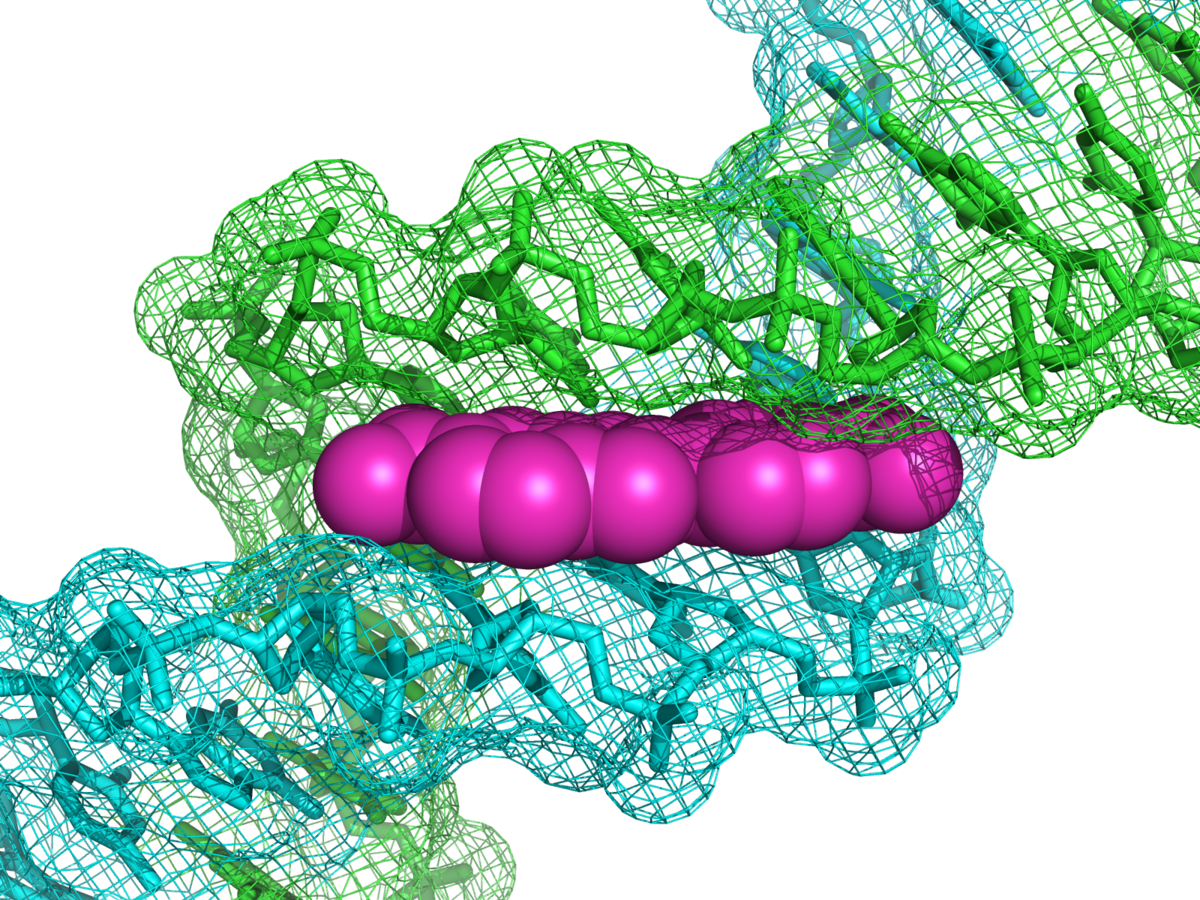
DNAの副溝(緑と青)に結合したDAPI(マゼンタ)。PDBから :1D30。 DAPIの青色発光は、単一のサンプルで複数の蛍光染色を使用したい顕微鏡検査医にとって便利です。DAPIと、フルオレセインや緑色蛍光タンパク質(GFP)などの緑色蛍光分子との間には、ある程度の蛍光の重複がありますが、この影響はわずかです。非常に正確な画像分析が必要な場合は、スペクトルアンミキシングを使用することでこの影響を説明できます。
分析用蛍光光学顕微鏡以外では、DAPIは、汚染されたマイコプラズマまたはウイルスのDNAを検出するための細胞培養の標識にも人気が増殖培地中の標識されたマイコプラズマまたはウイルス粒子は、DAPIで染色されると蛍光を発し、検出が容易になります。
吸収および蛍光特性のモデリング
このDNA蛍光プローブは、分極性連続体モデルのIEFバージョンと組み合わせて、時間依存密度汎関数理論を使用して効果的にモデル化されています。この量子力学的モデリングは、構造の柔軟性と分極の低下という観点から、DNAポケットへのマイナーな溝結合とインターカレーションによって与えられる吸収と蛍光の振る舞いを合理化しました。
生細胞と毒性
DAPIは固定細胞染色に使用できます。生細胞染色に必要なDAPIの濃度は一般的に非常に高いです。生細胞にはめったに使用されません。 MSDS で無毒と表示されており、大腸菌に対して変異原性があることは示されていませんが、メーカー情報では既知の変異原として表示されています。これは小さなDNA結合化合物であるため、発がん性の影響を与える可能性があり、取り扱いと廃棄には注意が必要です。
代替案

DAPI(青)、ファロイジン(赤)、および
フルオレセインイソチオシアネート(FITC)
に結合し
た抗体を介した
免疫蛍光(緑)で染色された内皮細胞 ヘキスト染色は、生細胞と固定細胞の両方のアプリケーションと互換性があり、DAPIと同じ機器のフィルター設定を使用して表示できる、青色蛍光DNA染色であるという点でDAPIに似ています。
参考文献
^ Kapuscinski、J。(1995年9月)。「DAPI:DNA特異的蛍光プローブ」。バイオテクノロジー。Histochem。70(5):220–233。土井:10.3109 / 10520299509108199。PMID8580206 。_
^ Invitrogen、DAPI Nucleic Acid Stain Archived 2009-03-06 at WaybackMachine。2009年12月8日にアクセス。
^ Scott Prahl、 DAPI。2009年12月8日にアクセス。
^ カプシチンスキー、J(2017)。「核酸と蛍光色素の相互作用:凝縮した複合体のスペクトル特性」。Journal of Histochemistry&Cytochemistry。38(9):1323–1329。土井:10.1177 /38.9.1696951。PMID1696951。_
^ ラッセル、WC; ニューマン、キャロル; ウィリアムソン、DH(1975)。「マイコプラズマとウイルスに感染した細胞のDNAを実証するための簡単な細胞化学的手法」。自然。253(5491):461–462。Bibcode:1975Natur.253..461R。土井:10.1038 / 253461a0。PMID46112。_ S2CID25224870。_
^ ビアンカルディ、アレッサンドロ; Biver、Tarita; Secco、Fernando; Mennucci、Benedetta(2013)。「量子力学的および分光学的ツールを介した副溝結合および挿入DAPIの光物理的特性の調査」。物理学 化学。化学。物理学。15(13):4596–603。Bibcode:2013PCCP … 15.4596B。土井:10.1039 / C3CP44058C。PMID23423468。_
^ Zink D、Sadoni N、Stelzer E(2003)。「生細胞のクロマチンと染色体の可視化。通常、生細胞の染色にはヘキスト染色が使用されます。DAPIは、固定細胞ではヘキスト染色と比較して高い信号を示しますが、生細胞ではヘキスト染色が使用されます。」メソッド。29(1):42–50。土井:10.1016 / S1046-2023(02)00289-X。PMID12543070。_
^ DAPI製品安全データシート。kpl.com
^ 太田T、時下S、山形H(2001)。「エチジウムブロマイドとSYBRグリーンIは、大腸菌における紫外線照射と化学変異原の遺伝子毒性を増強します」。Mutat。Res。492(1–2):91–7。土井:10.1016 / S1383-5718(01)00155-3。PMID11377248。_
も参照してください
コモンズには、DAPIに関連するメディアが
DNA結合リガンド
ヘキスト染色
レキシトロプシン
ネトロプシン
ペンタミジン”