ECW_model
化学では、ECWモデルは、ルイス酸とルイス塩基の相互作用の強さを記述および予測する半定量的モデルです。多くの化学反応は酸塩基反応として説明できるため、このような相互作用のモデルは潜在的に幅広い関心を集めています。モデルは最初にEとCのパラメータをすべての酸と塩基に割り当てました。その後、モデルはECWモデルに拡張され、酸塩基反応に先行するプロセスを表す一定のエネルギー項Wを持つ反応をカバーしました。この定量的モデルは、定性的HSAB理論とよく議論されます、また、多様な酸と塩基の挙動を合理化しようとしています。
コンテンツ
1 問題の歴史
2 EとCの方程式
3 ECWモデル
4 ECWモデルのグラフィック表示
5 ECWモデルの他の側面と拡張
6 I2の電荷移動錯体
7 ノート
8 参考文献
9 も参照してください
問題の歴史
早くも1938年に、GNルイスは、酸または塩基の相対強度は、それが測定された塩基または酸に依存することを指摘しました。酸または塩基の強さの単一の順位では、交差反応のエネルギーを予測することはできません。次の酸塩基反応のペアについて考えてみます。4F-C H
4 OH + OEt
2 −Δ
H = 5.94 kcal / mole4F-C H
4 OH + SMe2- ΔH= 4.73 kcal / mole
これらのデータは、OEt2がSMe2よりも強力な塩基であることを示唆しています。ただし、I 2が酸の場合は、逆になります。 I 2 + OEt
2 −Δ
H = 4.16 kcal / mole I 2 + SMe
2 −Δ
H = 7.63 kcal / mole
EとCの方程式
E – Cモデルは、酸と塩基の単一パラメーター記述の失敗に対応します。1965年、ラッセルS.ドラゴとブラッドフォードウェイランドは、各酸と各塩基が2つのパラメーターで記述されるように2項の方程式を発表しました。各酸はEAとCAによって特徴付けられます。各ベースは、同様に独自のEBとCBによって特徴付けられます。EパラメータとCパラメータは、それぞれ、酸と塩基が形成する結合の強度に対する静電的および共有結合的な寄与を示します。これらのパラメーターは、酸と塩基の間にσ結合のみを形成する付加物、および酸と塩基の間に立体反発を持たない付加物にエンタルピーを使用することによって経験的に得られました。− Δ H = E A EB + C A C B
{- Delta H = E_ {A} E_ {B} + C_ {A} C_ {B}}
この方程式は、多くの酸と塩基の間の反応のエンタルピーΔHを再現して予測します。ΔHは、気相と弱溶媒和媒体の両方における酸と塩基の間の結合の強さの尺度です。エントロピー効果は無視されます。方程式のマトリックス表現は、その有用性を高めます。
4つの値、2つのEと2つのCが参照として割り当てられました。I2のEAとCAが標準として選択されました。I 2は静電結合を起こしにくいため、E Aパラメータには0.5という小さな値を割り当て、共有結合特性のCAの値は2.0に設定しました。2つの塩基パラメータについて、CH3C(O)N(CH3)2(DMA )のEBは2.35に設定され、(C2H5)2S、ジエチルスルフィドのCBは3.92に設定された。このようにパラメーターを固定すると、DMAのE A EBおよびCA C B生成物と(C 2 H 5 ) 2 S付加物をヨウ素で固定することにより、データセットに共有静電モデルが課され、これら4つの値が保証されます。どのパラメータにも負の値はありませんでした。EC方程式が最初に提案されてから利用可能になったエンタルピーデータの増加により、パラメーターが改善されました。改善されたパラメータセットのE数とC数を古いパラメータと混合すると、計算が不正確になるため、回避する必要が改善されたEおよびC数の選択されたセットはにあり、完全なセットは文献で入手できます。 σ塩基性を測定するために、酸素、窒素、および硫黄ドナーの改善されたパラメーターと組み合わせて使用できるホスフィンのEBおよびCBパラメーターが報告されています。
ECWモデル
ECWモデルでは、新しい項Wが方程式に追加されました。− Δ H = E A E
B+ C A C B + W
{- Delta H = E_ {A} E_ {B} + C_ {A} C_ {B} + W}
W項は、二量体の酸または塩基を切断するための一定のエネルギーを表します。たとえば、塩基Bによる 2の開裂エンタルピーには、2つのステップが含まれます。最初のステップは、 Wである二量体の切断です。
1/2[Rh(CO)
2 Cl]
2 Rh(CO) 2 Cl W = -10.39 kcal / mol
2番目のステップは、BをRhCl(CO)2モノマーに結合することです。この場合、W = -10.39 kcal / molです。
その他の場合、Wは、H結合酸(CF 3)3COHの内部水素結合を切断するために必要なエンタルピーです。Wは、溶媒和が不十分な媒体での塩基置換反応にも役立ちます。 F 3 B-OEt2BF3 OEt 2 どの塩基でも、 F 3 B-OEt2結合の切断に対して一定のエネルギー寄与が観察されます。一連の塩基のエンタルピーのECW研究は、F 3 B-OEt2結合の解離エンタルピーに対応するW値を生成します。結果として生じるEAおよびCAパラメーターは、複合体化されていないBF3のパラメーターです。
ECWモデルのグラフィック表示
このモデルのグラフ表示は、酸または塩基の強さの単一のランク順がないことを明確に示しています。これは見落とされがちな点であり、酸と塩基の相互作用の大きさには、相互作用を説明するために2つのパラメーター(EとC)が必要であることを強調しています。
ECWモデルからのEC方程式− Δ H = E A EB + C A C B
{- Delta H = E_ {A} E_ {B} + C_ {A} C_ {B}}
直線としてプロットできる形に再配置することができます。
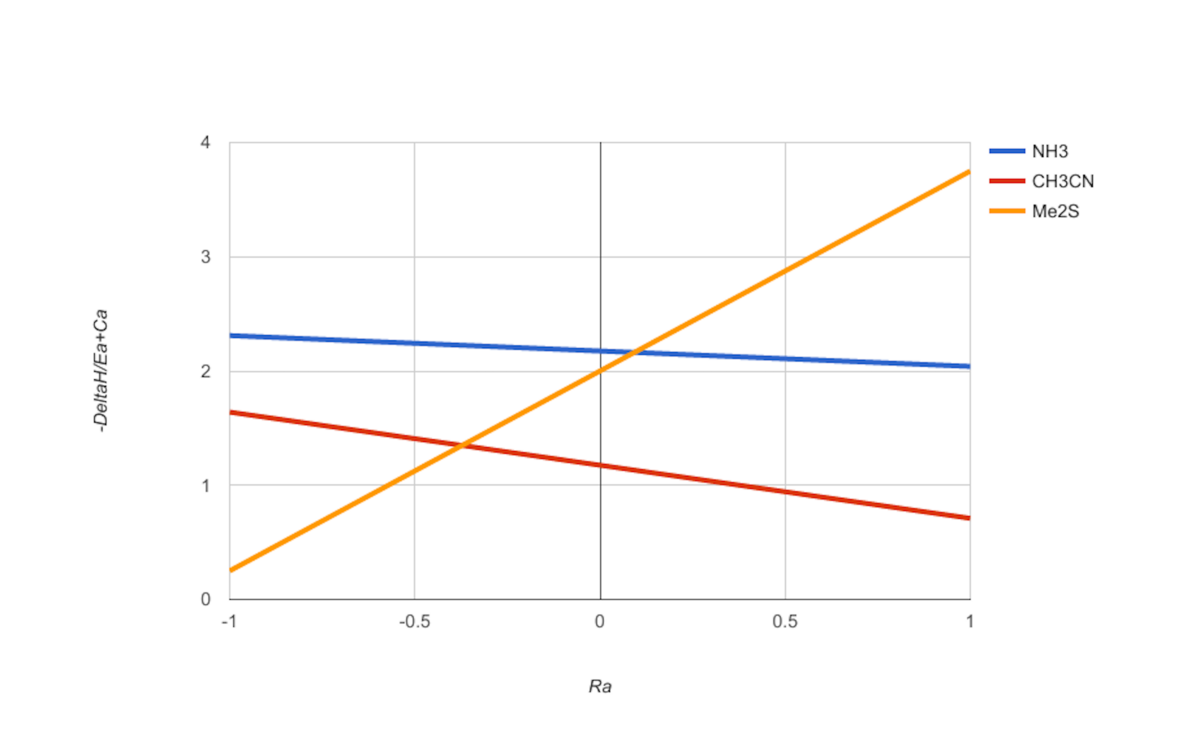
このグラフィカルなアプローチを示すために、3つのルイス塩基のみを使用したCBプロット。
ルイス塩基のCramer-Boppプロットでは、パラメーターR a は、純粋な静電相互作用( R a = -1)から純粋な共有相互作用(R a = +1 )までの潜在的なルイス酸パートナーの結合モードを反映しています。)。パラメータ− Δ H E a + C a { scriptstyle { frac {- Delta H} {E_ {a} + C_ {a}}}}
結合相互作用の強さを反映しています。ここに示すプロットでは、選択した3つのルイス塩基(アセトニトリル、アンモニア、および硫化ジメチル)を比較できます。ルイス酸ヨウ素(R a = 0.6)は、硫化ジメチルと最も強く相互作用し、アセトニトリルとは最も強く相互作用しませんが、トリエチルガリウム(R a = -0.65)は、アンモニアと最も強く相互作用し、硫化ジメチルと最も強く相互作用しません。プロットはまた、ルイス酸パートナーに関係なく、アンモニアがアセトニトリルよりも強いルイス塩基であることを示していますが、ルイス塩基としてのアンモニアと硫化ジメチルの相対強度は、ルイス酸の結合特性に依存し、R a = 0.1の場合は順序が入れ替わります。(注:推測)。 Cramer-Boppプロットは、ルイス塩基の強度を可能なルイス酸パートナーの範囲と比較するための視覚的なツールとして開発されました。同様のプロットを作成して、選択したルイス酸を可能なルイス塩基の範囲と比較することができます。参考文献4、8、11、および13には、多くのルイス酸および塩基の強度の順位を定義するグラフ表示が含まれています。
ECWモデルの他の側面と拡張
上記のように、EおよびCパラメータは、酸と塩基の間の結合がσ相互作用である付加物形成のエンタルピーと、酸と塩基の間に立体反発を持たない付加物から得られます。その結果、EおよびCパラメータを使用してパイ結合に関する情報を収集できます。パイ結合が測定されたエンタルピーに寄与する場合、EおよびCパラメーターから計算されたエンタルピーは測定されたエンタルピーよりも小さくなり、その差がパイ結合の寄与の程度の尺度を提供します。
Me 3BとMe3 Nの反応について計算されたᐃHは、観測されたものよりも大きくなっています。この不一致は、BとNのメチル基間の立体反発に起因します。計算値と観測値の差は、立体効果の量と見なすことができます。これは、他の方法では達成できない値です。立体効果は、(CH 3)3 SnClおよびCu(HFacac)2でも確認されています。
EおよびCパラメータの使用は、付加物形成中に発生する分光学的変化を分析するために拡張されました。たとえば、付加物形成時に発生するフェノールOH伸縮周波数のシフトΔχは、次の式を使用して分析されています。
Δχ = ΕA ∗ E B + C A ∗ C B + W ∗ _ _
ここで、フェノールのEAおよびCAのアスタリスクは、アクセプターが一定に保たれ、ベースが変化するにつれて周波数シフトが測定されることを示します。アスタリスクは、フェノールパラメータが周波数シフトのパラメータであり、エンタルピーのパラメータではないことも示しています。このような分析は、周波数シフトのドナー強度の参照スケールとしてEBおよびCBパラメーターを使用するための基礎を提供します。このタイプの分析は、付加物の形成に伴う他の分光学的シフト(NMR、EPR、UV-vis、IRなど)にも適用されています。σドナー-アクセプター相互作用によって支配される物理化学的特性Δχは、エンタルピー由来のEおよびCパラメーターと相関させることができます。
ECW方程式により、電子移動が制限されている中性のドナー-アクセプター相互作用の付加物形成のエンタルピーを相関させて予測することができます。陽イオンと中性ドナー間の気相反応では、かなりの電子移動がECWモデルの陽イオン中性ルイス塩基相互作用への拡張により、 ECTモデルが生まれました。 他の人々は、ECWモデルは「溶液化学および生化学の多くの分野で一般的に有用であることがわかっている」と結論付けています。
酸の選択され
たEおよび
Cパラメータ
酸E A C A W
C A / E AI 2 0.50 2.0 0
4.0 4.0IBr 1.20 3.29 0 2.7 ICl 2.921.66 0 0.57
C 6 H 5 OH2.27 1.07 0 0.47
4-FC 6 H 4 OH2.30 1.11 0 0.48
3-CF 3 C 6 H 4 OH2.38 1.22 0 0.51
4-CH 3 C 6 H 4 OH2.23 1.03 0 0.44
CF 3 CH 2 OH2.07 1.06 0 0.51(CF 3)2 CHOH2.89 1.33
−0.16 0.46 (CH 3)3 COH1.07 0.69 0 0.65(CF 3)3 COH3.06 1.88
−0.87 0.61 C 8 H 17 OH0.85 0.87 0 1.0 HCCl 3 1.56 0.440 0.28
CH 2 Cl 20.86 0.11 0 0.13
C 4 H 4 NH1.38 0.68 0 0.49 HNCO 1.60 0.690 0.43 HNCS 2.85 0.70 0 0.25 B(CH 3)32.90 3.60 0 1.2
Al(CH 3)38.66 3.68 0 0.43
Ga(C 2 H 5)36.95 1.48 0 0.21
In(CH 3)36.60 2.15 0 0.33(CH 3)3 SnCl2.87 0.71 0 0.25 SO 2 0.51 1.560 3.1 SbCl 5 3.64 10.42 0 2.9 Cu(HFacac)2 1.82 2.86 0 1.6
Zn [N(Si(CH 3)3 ] 22.75 2.32 0 0.84
Cd [N(Si(CH 3)3 ] 22.50 1.83 0 0.73
Zn TPP 2.72 1.45 0 0.53
Co PPIX DME 2.32 1.34 0 0.58
½[MeCo(Hdmg)2 ] 2 4.70 3.24
−5.84 0.60 ½ 24.32 4.13
−10.39 0.96 ½ 22.43 2.56
−5.78 1.1 ½ [Pd(π-ally)Cl] 21.70 2.14
−3.38 1.3 [Ni(TFAcCAM)2 ] 2 1.55 1.32 0 0.85
Mo 2 PFB 4 3.15 1.05 0 0.33
と基地の場合
ベースE B C B
C B / E BNH 3 2.31 2.04 0.88
NH 2(CH 3)2.16 3.13 1.4
NH(CH 3)21.80 4.21 2.3
N(CH 3)31.21 5.61 4.6
HC(C 2 H 4)3 N0.80 6.72 8.4(C 2 H 5)3 N1.32 5.73 4.3
1-CH 3 NC 3 N 1.16 4.92 4.2
C 5 H 5 N1.78 3.54 2.0
3CH 3 C 5 H 4 N1.81 3.67 2.0
3BrC 5 H 4 N1.66 3.08 1.9
4CH 3 OC 5 H 4 N1.83 3.83 2.1
CH 3 CN1.64 0.71 0.43(CH 3)2 NCN1.92 0.92 0.48
ClCH 2 CN1.67 0.33 0.20
CH 3 C(O)CH 31.74 1.26 0.72(CH 2)4 CO2.02 0.88 0.43
CH 3 C(O)OC 2 H 51.62 0.98 0.61
CH 3 C(O)N(CH 3)22.35 1.31 0.56(C 2 H 5)2 O1.80 1.63 0.91(CH 2)4 O1.64 2.18 1.3
O(C 2 H 4)2)O1.86 1.29 0.69(CH 2)4(CH)2)O 1.45 2.14 1.5(CH 3)2 S0.25 3.75 15(CH 2)4 S0.26 4.07 16(C 2 H 5)2 S0.24 3.92 16(CH 3)2 SO2.40 1.47 0.61(CH 2)4 SO2.44 1.64 0.67
C 5 H 5 NO2.29 2.33 1.0
4CH 3 OC 5 N 4 NO2.34 3.02 1,3(C 6 H 5)3 PO2.59 1.67 0.64(CH 3)3 P0.25 5.81 24(CH 3 O)3 P0.13 4.83 37(CH 3)2 Se0.05 4.24 83(C 6 H 5)3 PS0.35 3.65 10
C 6 H 60.70 0.45
0.64
I2の電荷移動錯体
いくつかのドナー-I2付加物の生成エンタルピーを以下に示します。I 2は軟酸として分類されるルイス酸であり、そのアクセプター特性はECWモデルで説明されています。他のルイス酸と比較した、一連の塩基に対するI 2の相対的なアクセプター強度は、CBプロットで示すことができます。
一部のドナー-I2付加物の
生成エンタルピー
ベース
−Δ H(kcal / mol)
ベンゼン 1.4 トルエン 1.8 ジオキサン 3.5 ジエチルエーテル 4.3 ジエチルスルフィド 8.3 ジメチルアセトアミド 4.7 アセトニトリル 1.9 ピリジン 7.80 トリエチルアミン
12.0
ノート
^ ( C A − E A)/( C A + E A) ^ E A、およびC Aの単位は(kcal / mol)1⁄2であり、Wはkcal / molです。
^ ビス(ヘキサフロロアセチルアセトナト)銅(II)
^ 亜鉛テトラフェニルポルフィン ^ コバルト(II)プロトポルヒリンIXジメチルエステルIX
^ メチルコバロキシム
^ ビス(3-トリフルオロ-d-カンフォレート)ニッケル(II)二量体 ^ モリブデンパーフルオロブチレート
^ EBとCBの単位は( kcal / mol)です 1⁄2 _ _ ^ N-メチルイミダゾール
^ 7-オキサビシクロヘプタン
参考文献
^ ルイスGN(1938)酸と塩基フランクリン研究所のジャーナル、226、293-313。
^ ドラゴ、RS; ウェイランド、BB(1965)。「ルイス酸-塩基相互作用のエンタルピーを相関させるためのダブルスケール方程式」。アメリカ化学会誌。87:3571–3577。土井:10.1021 / ja01094a008。
^ ドラゴ、RS; フォーゲル、GC; ニーダム、TE(1971)。「付加物形成のエンタルピーを予測するための4パラメータ方程式」。アメリカ化学会誌。93:6014〜6026。土井:10.1021 / ja00752a010。
^ ドラゴ、R、S。; フェリス、DCP; ウォン、NM(1990)。「気相イオン分子エンタルピーの分析と予測のための方法」。アメリカ化学会誌。112:8953-8961-2479。土井:10.1021 / ja00180a047。 {{cite journal}}:CS1 maint:複数の名前:著者リスト(リンク)
^ フォーゲルGC; ドラゴ、RS(1996)。「ECWモデル」。化学教育ジャーナル。73:701–707。Bibcode:1996JChEd..73..701V。土井:10.1021 / ed073p701。
^ ドラゴ、R、S。; Dadmum、AP; フォーゲル、GC(1992)。「EおよびCモデルへの新しいドナーの追加」。無機化学。32:2473–2479。土井:10.1021 / ic00063a045。 {{cite journal}}:CS1 maint:複数の名前:著者リスト(リンク)
^ ドラゴ、RS; ジョーグ、S。(1996)。「ホスフィンEBおよびCB値」。アメリカ化学会誌。118:2654–2663。土井:10.1021 / ja953581e。
^ クレイマー、RE; ボップ、TT(1977)。「ルイス酸および塩基の付加物形成のエンタルピーのグラフ表示」。化学教育ジャーナル。54:612–613。土井:10.1021 / ed054p612。 このペーパーに示されているプロットは、古いパラメーターを使用しています。改善されたE&Cパラメータは、表と参考文献5および6にリストされています。
^ ドラゴ、RS; ビルグリエン、CJ(1988)。「金属-金属結合系における配位子の誘導移動と配位」。多面体。7:1453–1468。土井:10.1016 / S0277-5387(00)81774-X。
^ Drago、R、S。(1982)。「テトラ酪酸二ロジウム付加物の.pi.-バックボンド安定化につながる相乗的な金属-金属相互作用の問題」。Inorg。化学。21:1697–1698。土井:10.1021 / ic00134a093。 {{cite journal}}:CS1 maint:複数の名前:著者リスト(リンク) ^ ドラゴ、R、S。; フォーゲル、GC(1992)。「付加物形成時の分光学的変化の解釈と、静電および共有(EおよびC)パラメーターを決定するためのそれらの使用」。アメリカ化学会誌。114:9527–9532。土井:10.1021 / ja00050a035。 {{cite journal}}:CS1 maint:複数の名前:著者リスト(リンク) ^ Drago、化学における静電共有結合モデルのRSアプリケーション、サーフサイド:フロリダ州ゲインズビル、1994年。
^ Drago、R。Wong NS(1996)。「化学反応性と結合の理解における電子密度移動と電気陰性度の役割」。化学教育ジャーナル。73:123–129。土井:10.1021 / ed073p123。 {{cite journal}}:CS1 maint:作成者パラメーターを使用します(リンク) ^ ローレンス、C。およびギャル、JF。ルイスの塩基性と親和性の尺度、データと測定、(Wiley 2010)p 51 IBSN 978-0-470-74957-9 ^ ローレンス、C。およびギャル、JF。ルイスの塩基性と親和性の尺度、データと測定、(Wiley 2010)pp 50-51 IBSN 978-0-470-74957-9
も参照してください
酸塩基反応
ルイス酸–ルイス塩基 酸 ラッセル・S・ドラゴ”
 この方程式は、多くの酸と塩基の間の反応のエンタルピーΔHを再現して予測します。ΔHは、気相と弱溶媒和媒体の両方における酸と塩基の間の結合の強さの尺度です。エントロピー効果は無視されます。方程式のマトリックス表現は、その有用性を高めます。
この方程式は、多くの酸と塩基の間の反応のエンタルピーΔHを再現して予測します。ΔHは、気相と弱溶媒和媒体の両方における酸と塩基の間の結合の強さの尺度です。エントロピー効果は無視されます。方程式のマトリックス表現は、その有用性を高めます。