Hexokinase
ヘキソキナーゼは、ヘキソース(六炭糖)をリン酸化してヘキソースリン酸を形成する酵素です。ほとんどの生物では、グルコースがヘキソキナーゼの最も重要な基質であり、グルコース-6-リン酸が最も重要な生成物です。ヘキソキナーゼは、無機リン酸基を ATP から基質に転移する能力を持っています。
ヘキソキナーゼ
Kluyveromyces lactis 由来のヘキソキナーゼ 1 の結晶構造 。 識別子
EC番号
2.7.1.1
CAS番号
9001-51-8
データベース
インテンツ
IntEnz ビュー
ブレンダ
ブレンダエントリー ExPASy NiceZyme ビュー KEGG KEGGエントリー
メタサイク
代謝経路
プリアム
プロフィール
PDB構造
RCSB PDB PDBe PDBsum
遺伝子オントロジー
アミGO / QuickGOす PMC
記事 PubMed 記事 NCBI タンパク質
ヘキソキナーゼ 1
ヘキソキナーゼ 1、ホモ二量体、ヒト
識別子
シンボル HK1 NCBI遺伝子098 HGNC 922
オミム42600 RefSeq M_000188
ユニプロット P19367 その他のデータ
軌跡
Chr. 10q22 _検索する 構造物
スイスモデル
ドメイン
インタープロ
ヘキソキナーゼ 2
識別子
シンボル HK2 NCBI遺伝子099 HGNC 923
オミム01125 RefSeq M_000189
ユニプロット P52789 その他のデータ
軌跡
Chr. 2 p13検索する 構造物
スイスモデル
ドメイン
インタープロ
ヘキソキナーゼ 3 (白血球)
識別子
シンボル HK3 NCBI遺伝子101 HGNC 925
オミム42570 RefSeq M_002115
ユニプロット P52790 その他のデータ
軌跡
Chr. 5 q35.2検索する 構造物
スイスモデル
ドメイン
インタープロ
ヘキソキナーゼ_1
ヒトグルコキナーゼの結晶構造
識別子
シンボル
ヘキソキナーゼ_1
プファム PF00349 プファム一族 CL0108 インタープロ IPR022672 プロサイトDOC00370 SCOP2
1cza / SCOPE / SUPFAM
利用可能なタンパク質構造:
プファム
構造物/ ECOD PDB RCSB PDB ; PDBe ; PDBj PDBsum 構造概要
ヘキソキナーゼ_2
ラット脳ヘキソキナーゼ i 型複合体とグルコースおよび阻害剤グルコース-6-リン酸
識別子
シンボル
ヘキソキナーゼ_2
プファム PF03727 プファム一族 CL0108 インタープロ IPR022673 プロサイトDOC00370 SCOP2
1cza / SCOPE / SUPFAM
利用可能なタンパク質構造:
プファム
構造物/ ECOD PDB RCSB PDB ; PDBe ; PDBj PDBsum 構造概要
ヘキソキナーゼを、ヘキソキナーゼの特定のアイソフォームであるグルコキナーゼと混同しないですべてのヘキソキナーゼはいくつかのヘキソースをリン酸化することができますが、グルコキナーゼは 50 倍低い基質親和性で作用し、その主なヘキソース基質はグルコースです。
コンテンツ
1 変化
2 反応
3 ヘキソースリン酸化の結果
4 異なるアイソフォームのサイズ
5 哺乳類のヘキソキナーゼの種類
5.1 ヘキソキナーゼ I、II、および III 5.2 ヘキソキナーゼ IV (「グルコキナーゼ」)
6 解糖では
7 ミトコンドリアとの関連
8 ハイドロパシープロット
9 欠乏
10 こちらもご覧ください
11 参考文献
変化
ヘキソキナーゼをコードする遺伝子は生命のあらゆる領域で発見されており、細菌、酵母、植物からヒトや他の脊椎動物に至るまで、さまざまな種に存在します。それらはアクチン フォールドタンパク質として分類され、基質親和性やその他の特性を決定するより可変性の配列に囲まれた共通のATP結合部位コアを共有します。
異なる機能を提供するいくつかのヘキソキナーゼ アイソフォームまたはアイソザイムが、単一の種で発生する可能性が
反応
ヘキソキナーゼによって媒介される細胞内反応は、次のように分類できます。
ヘキソース-CH
2 OH + MgATP
2− ヘキソース-CH
2 O-PO
2−3 _+MgADP
−+ H + ここで、ヘキソース-CH 2 OH は、アクセス可能な -CH 2 OH 部分を含むいくつかのヘキソース (グルコースなど) のいずれかを表します。

ヘキソースリン酸化の結果
グルコースなどのヘキソースのリン酸化は、多くの場合、解糖やグリコーゲン合成などの多くの細胞内代謝プロセスに制限されます。これは、リン酸化されたヘキソースが帯電しているため、細胞外への輸送がより困難になるためです。
本態性フルクトスリアの患者では、ヘキソキナーゼによるフルクトースのフルクトース-6-リン酸への代謝が食事フルクトースの主要な代謝方法です。この経路は、正常な個人では重要ではありません。
異なるアイソフォームのサイズ
ほとんどの細菌ヘキソキナーゼは、サイズが約 50 kD です。植物や動物を含む多細胞生物は、多くの場合、複数のヘキソキナーゼ アイソフォームを持っています。ほとんどのサイズは約 100 kD で、2 つの半分 (N 末端と C 末端) で構成されており、多くの配列相同性を共有しています。これは、細菌のヘキソキナーゼに類似した50kDの祖先ヘキソキナーゼの複製と融合による進化の起源を示唆しています。
哺乳類のヘキソキナーゼの種類
4 つの重要な哺乳動物ヘキソキナーゼ アイソザイム ( EC 2.7.1.1 ) があり、これらは異なる基質と条件、および生理学的機能に関して細胞内の位置と動態が異なります。それらは、ヘキソキナーゼI、II、III、およびIV、またはヘキソキナーゼA、B、C、およびDと指定されています。
ヘキソキナーゼ I、II、および III
ヘキソキナーゼI、II、およびIIIは、グルコースに対する親和性が高い(1mM未満)ため、「低Km 」アイソザイムと呼ばれる。ヘキソキナーゼ I および II は、基質の生理的濃度でミカエリス-メンテン速度論に従います。 3 つすべてが、その製品であるグルコース-6-リン酸によって強く阻害されます。分子量は約 100 kD です。それぞれが 2 つの類似した 50kD の半分で構成されていますが、両方の半分が機能的な活性部位を持っているのはヘキソキナーゼ II のみです。
ヘキソキナーゼ I/A はすべての哺乳類の組織に見られ、「ハウスキーピング酵素」と見なされ、ほとんどの生理学的、ホルモン、および代謝の変化の影響を受けません。
ヘキソキナーゼ II/B は、多くの細胞型で主要な制御アイソフォームを構成し、多くの癌で増加しています。筋肉や心臓にあるヘキソキナーゼです。ヘキソキナーゼ II はミトコンドリアの外膜にもあるため、ATP に直接アクセスできます。ヘキソキナーゼ II の相対比活性は、少なくとも 6.9 ~ 8.5 の pH 範囲で pH とともに増加します。
ヘキソキナーゼ III/C は、生理的濃度のグルコースによって基質阻害されます。このアイソフォームの調節特性についてはほとんど知られ
ヘキソキナーゼ IV (「グルコキナーゼ」)
グルコキナーゼ
グルコキナーゼとも呼ばれる哺乳動物のヘキソキナーゼ IV は、他のヘキソキナーゼとは動態や機能が異なります。
細胞内レベルでのリン酸化の位置は、グルコキナーゼが肝細胞の細胞質と核の間を移動するときに発生します。グルコキナーゼは、この基質の濃度が十分に高い場合にのみグルコースをリン酸化できます。グルコースに対するその Km は、ヘキソキナーゼ I、II、および III の 100 倍です。
ヘキソキナーゼ IV は約 50kD の単量体であり、グルコースとの正の協同性を示し、その生成物であるグルコース-6-リン酸によってアロステリックに阻害されません。
ヘキソキナーゼ IV は、肝臓、膵臓、視床下部、小腸、およびおそらく他の特定の神経内分泌細胞に存在し、炭水化物代謝において重要な調節的役割を果たしています。膵島のベータ細胞では、インスリン放出を制御するグルコースセンサーとして機能し、同様にアルファ細胞でのグルカゴン放出を制御します。肝臓の肝細胞では、グルコキナーゼは、グリコーゲン合成を増加または減少させることにより、周囲のグルコースレベルの変化に反応します.
解糖では
グルコースは、酸素分子 (O 2 )の存在下と非存在下の両方で、すべての細胞で ATP を生成するために使用できるという点で独特です。解糖の最初のステップは、ヘキソキナーゼによるグルコースのリン酸化です。
D -グルコース ヘキソキナーゼ
α- D -グルコース-6-リン酸
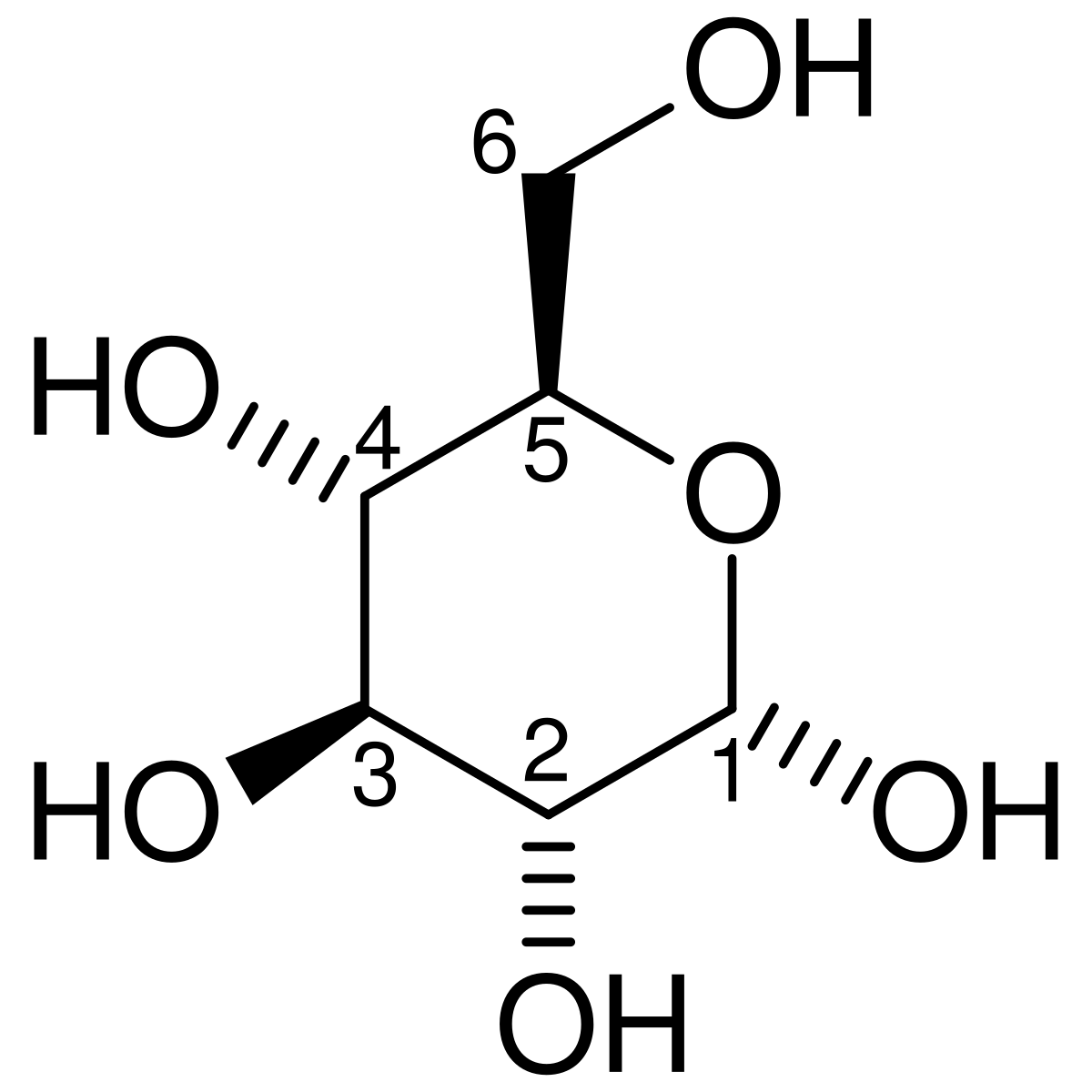

ATP ADP 
KEGG Pathway Databaseの化合物C00031 。 KEGG Pathway DatabaseのEnzyme 2.7.1.1 。 KEGG Pathway Databaseの化合物C00668 。 KEGG経路データベースの反応R01786 。
ヘキソキナーゼは、グルコースのリン酸化を触媒してグルコース 6-リン酸を生成することにより、細胞へのグルコースの輸送を促進する下り坂の濃度勾配を維持します。この反応はまた、解糖およびペントースリン酸経路を含む、グルコース利用のすべての生理学的に関連する経路を開始します。ヘキソースの 6 位に荷電したリン酸基を付加すると、荷電した細胞内のグルコースおよび 2-デオキシヘキソース グルコース類似体 (2-デオキシグルコース、2-フルオロ-2-デオキシグルコースなど) の「捕捉」も確実になります。ヘキソースリン酸は細胞膜を容易に通過できません。
ミトコンドリアとの関連
ヘキソキナーゼ I および II は、ミトコンドリアの外膜の外表面に、ポリンへの特異的結合、または電位依存性陰イオン チャネルを介して物理的に関連付けることができます。この関連付けにより、ヘキソキナーゼの 2 つの基質の 1 つであるミトコンドリアによって生成される ATP へのヘキソキナーゼの直接アクセスが可能になります。ミトコンドリアのヘキソキナーゼは、急速に増殖する悪性腫瘍細胞で非常に上昇しており、そのレベルは正常組織の最大 200 倍です。ミトコンドリアに結合したヘキソキナーゼは、腫瘍細胞で好気的に起こる非常に高い解糖速度の推進力であることが実証されています( 1930 年にOtto Heinrich Warburgによって記述された、いわゆる Warburg 効果)。
ハイドロパシープロット

ヘキソキナーゼのハイドロパシープロット
タンパク質の潜在的な膜貫通部分は、ハイドロパシー分析によって検出できます。ハイドロパシー分析では、ポリペプチド鎖に沿った各位置の疎水性を定量化するアルゴリズムを使用します。受け入れられているハイドロパシー スケールの 1 つは、ハイドロパシー プロットの生成に依存する Kyte と Doolittle のものです。これらのプロットでは、y 軸上の負の数は親水性領域を表し、正の数は疎水性領域を表します。潜在的な膜貫通ドメインは、x 軸上で約 20 アミノ酸長です。
酵母におけるヘキソキナーゼのハイドロパシー分析は、これらの基準によって作成されています。あたかもヘキソキナーゼがアミノ酸 400 付近に位置する単一の潜在的な膜貫通ドメインを所有しているように見えます。したがって、ヘキソキナーゼは酵母の内在性膜タンパク質ではない可能性が最も高いです。
欠乏
ヘキソキナーゼ欠乏症は、慢性溶血性貧血を引き起こす遺伝的常染色体劣性疾患です。慢性溶血性貧血は、HK酵素をコードするHK遺伝子の変異によって引き起こされます。この変異により、HK 活性が低下し、ヘキソキナーゼ欠損症が引き起こされます。
こちらもご覧ください
アロステリー
酵素触媒作用
柔軟なリンカー
蛍光グルコースバイオセンサー
グルコキナーゼ
解糖系
グリコーゲン
グルコース 6-ホスファターゼ
ヘキソースリン酸の取り込み
インスリン
タンパク質ドメインのダイナミクス
タンパク質の柔軟性
参考文献
^ PDB : 3O08 ; Kuettner EB、Kettner K、Keim A、Svergun DI、Volke D (2010)。「結晶形Iの二量体KlHxk1の結晶構造」。ドイ: 10.2210/pdb3o08/pdb。 {{cite journal}}:引用ジャーナルが必要です|journal=( help ) ^
「Uniprot のヘキソキナーゼ データ」 . uniprot.org。
^Šimčíková D、Heneberg P (2019 年 8 月)。「酵素アッセイの結果におけるATP媒介バイアス補正による、ヒトグルコキナーゼの最適アルカリ性pHの同定」 . 科学レポート。9 (1): 11422. ビブコード: 2019NatSR …911422S . ドイ: 10.1038/s41598-019-47883-1 . PMC 6684659 . PMID 31388064。
^ロビー、RB。ヘイ、N (2006)。「ミトコンドリアのヘキソキナーゼ、成長因子と Akt の抗アポトーシス効果の新規メディエーター」 . がん遺伝子。25 (34): 4683–96. ドイ: 10.1038/sj.onc.1209595 . PMID 16892082。
^ブスタマンテ E、ペダーセン P (1977)。「培養ラットヘパトーマ細胞の高好気性解糖:ミトコンドリアヘキソキナーゼの役割」 . Proc Natl Acad Sci USA . 74 (9): 3735–9. ビブコード: 1977PNAS…74.3735B . ドイ: 10.1073/pnas.74.9.3735 . PMC 431708 . PMID 198801 . ^ Bowen, RA Molecular Toolkit: Protein Hydrophobicity Plots. コロラド州立大学、1998 年。ウェブ。< http://www.vivo.colostate.edu/molkit/index.html 2010 年 6 月 25 日にWayback Machineでアーカイブ> ^
「ヘキソキナーゼ欠乏症」 . エネルカ。エネルカ。2020 年 8 月 8 日にオリジナルからアーカイブされました。2017年4月6日閲覧。
ポータル:
![]()
生物学”