Hofmann%E2%80%93L%C3%B6ffler_reaction
Hofmann–Löffler反応(Hofmann–Löffler–Freytag反応、Löffler–Freytag反応、Löffler–Hofmann反応、およびLöfflerの方法とも呼ばれます)は、環状アミン2(ピロリジンまたは場合によってはピロリジン)が反応する有機反応です。 、ピペリジン)は、強酸(濃硫酸または濃CF 3 CO 2 H )の存在下でのN-ハロゲン化アミン1の熱または光化学分解によって生成されます。)。Hofmann–Löffler–Freytag反応は、分子内水素原子の窒素中心ラジカルへの移動を介して進行し、リモートの分子内フリーラジカルC–H官能基化の例です。
Hofmann–Löffler–Freytag反応
にちなんで名付けられた
アウグストヴィルヘルムフォンホフマン カールレーフラーカートフライターク
反応タイプ
閉環反応
コンテンツ
1 歴史的展望
2 反応機構
2.1 メカニズム研究
2.1.1 立体化学
2.1.2 同位体効果
2.1.3 開始、抑制、触媒作用
2.1.4 中級者
2.1.5 水素移動の選択性
2.2 一般的に受け入れられているメカニズム
3 反応の一般的な特徴
4 変更と改善
5 合成におけるアプリケーション
5.1 標準状態でのHofmann–Löffler–Freytag反応 5.2 穏やかな条件下でのHofmann–Löffler–Freytag反応
6 も参照してください
7 参考文献
歴史的展望
1878年、ピペリジンの構造はまだ不明であり、AW Hofmann は、化合物が不飽和であると信じて、塩化水素または臭素を添加しようとしました(つまり、彼は標準的なアルケン分類テスト反応を実行しました)。彼の研究の過程で、AWホフマンは多くのN-ハロアミンとN-ハロアミドを合成し、酸性および塩基性条件下でのそれらの反応を調査しました。 彼は、1-ブロモ-2-プロピルピペリジン(3)を熱硫酸で処理した後、塩基性後処理を行うと、第三級アミンが形成されると報告しました 。後に δ-コネセインであることが示されました(4)。

Hofmann-Löffler-Freytag反応はピロリジンの形成のための一般的で迅速なプロセスになるはずでしたが、反応のさらなる例が報告されたのはHofmannの研究から約25年後のことでした。1909年、K.LöfflerとC. Freytagは、この変換の範囲を単純な2級アミンに拡大し、N-ブロモ-N-メチル-4-からのニコチン(6)のエレガントな合成によって例示されるように、プロセスの合成的有用性を実証しました。 (ピリジン-3-イル)ブタン-1-アミン(5)。

反応機構
メカニズム研究
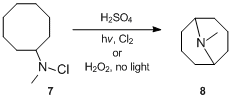
反応は1883年に最初に報告されましたが、そのメカニズムの詳細は1950年代後半に解明されました。Hofmann–Löffler–Freytag反応のメカニズムは、さまざまなN-ハロゲン化アミンの環化反応を研究したS.Wawzonekによって最初に調査されました。 1949年、WawzonekとThelan は、塩素の存在下で紫外線を照射した場合、または過酸化水素で処理した場合の硫酸中のN-クロロ-N-メチルシクロオクチルアミン7の溶液を報告しました。暗所では、光と過酸化物の非存在下で形成されるよりもはるかに多くのN-メチルグラナチニン8の収率が最大24%になりました。この証拠に基づいて、彼らは、反応がラジカル連鎖反応経路を介して進行することを正しく提案した。より具体的には、WawzonekとThelan は、N-クロラミンが最初に酸でプロトン化され、次に熱、光、または他の開始剤の影響下でホモリティック開裂を受けて、アンモニウムと塩化物のフリーラジカルを生成することを示唆しました。アンモニウムラジカルは、分子内で立体的に有利な水素原子を引き抜いてアルキルラジカルを生成し、連鎖反応において、別のN-クロロアンモニウムイオンから塩素を引き抜いて、塩化アルキルと新しいアンモニウムラジカルを形成します。塩化アルキルは後にアルカリの影響下で環化され、環状第三級アミンが生成されます。
より詳細なメカニズムの研究は、EJCorey らによって実施されました。、メカニズムに関連する反応のいくつかの特徴を調べた:立体化学、水素同位体効果、開始、阻害、触媒作用、中間体および水素移動の選択性。以下に示す結果は、伝播ステップの1つとして分子内水素移動を伴うフリーラジカル連鎖メカニズムを決定的に示しています。
立体化学
N-ハロアミンの環化における水素の置換が保持、反転、または立体配置の平衡化を伴うかどうかを決定するために、重水素化アミン9を合成した。9の塩素化とそれに続く90°Cの硫酸中でのN-クロロ誘導体10の熱分解により、光学的に不活性な1,2-ジメチルピロリジンが生成されました。この実験的観察は、 sp2混成δ炭素を持つ種の中間性を支持する強力な証拠でした。

同位体効果
10の分解におけるδ -Hの置換に対する水素同位体効果は、重水素含有量について1,2-ジメチルピロリジン11と1,2-ジメチルピロリジン-2-d12の混合物を分析することによって決定されました。重水素化および非重水素化1,2-ジメチルピロリジンの混合物の燃焼分析では、分子あたり0.78原子の重水素の値が得られました。これは、3.54の同位体効果( k H / k D )に対応します。同位体効果の値は、10の環化と1の純粋なサンプルからの混合1,2-ジメチルピロリジンの赤外スペクトルにおけるCD伸縮吸収の強度の比較に依存する重水素分析の独立した方法によって検証されました。 、2-ジメチルピロリジン-2- d 12; IRベースの分析では、3.42のk H / k Dが生成されました。これは、燃焼分析と一致しています。一次炭素への環化のためにkH/ k Dを決定するために行われた研究でも、k H / k D >> 1が得られました。これは、遷移状態でCH結合の切断がかなりの程度進行することを強く示唆しています。
開始、抑制、触媒作用
N-クロロジ-n-ブチルアミンは、25°Cの暗所で85%H 2 SO 4中で安定であることが観察されましたが、UV光を照射するとすぐに消失し始めました。反応は照射開始後約12分の誘導期間を有することが見出されたが、反応が窒素雰囲気下で行われた場合、それはほぼ完全に排除された。無酸素条件下で、N-ハロアミンの光触媒分解速度の有意な増加が報告されました。これらの観察は、分子状酸素による反応の阻害の強力な証拠を提供しました。
暗所でH2SO4中のジブチルクロロアミンの溶液に触媒量のFe2+塩を添加すると、クロロアミンが消失することにも注意した。N-ブチルピロリジンは、後処理時に良好な収率で単離された。この観察結果は、クロロアミンの分解が、酸化還元プロセスでFe2 +イオンによって開始されるフリーラジカル連鎖反応であることを明確に示しています。
さらなる調査により、紫外線触媒によるジブチルクロロアミンの分解速度と新たに形成されたピロリジンの収率の両方が反応媒体の酸性度に強く依存することが示されました。硫酸濃度の増加に伴い、より速く、より高い収率の反応が観察されました。
酸の役割を議論する際の重要な問題は、N-ハロアミンが開始段階で遊離塩基または塩の形で反応するかどうかです。2°アルキルアミンの共役酸のpKa値(一般に10〜11の範囲)に基づくと、 N-クロロアミンは主に高硫酸濃度の溶液中に塩として存在することが明らかです。結果として、化学的または熱的開始の場合、アンモニウムフリーラジカルを与えるのはN-クロロアンモニウムイオンであると仮定することは合理的です。しかし、紫外線を照射して反応を開始すると状況が変わります。光化学反応を起こすには、放射線を吸収し、入射光の量子がN-Cl結合を解離するのに十分な大きさである必要がN-クロロアミンの共役酸は225mμを超えると感知できるほどのUV吸収がないため、遊離のN-クロロアミンは解離を引き起こすのに十分なエネルギーのUV光を吸収します(λmax263mμ 、εmax300)。この場合、ほとんどの開始の原因となるのは、実際には遊離N-クロロアミンのわずかな割合です。また、新たに生成された中性窒素ラジカルが即座にプロトン化されることが示唆された。ただし、反応がUV光で開始されると、別のシナリオが実行される可能性があることを理解することが重要です。つまり、遊離のN-ハロアミンは照射時に解離しないかもしれませんが、代わりに光増感剤として機能するかもしれません。より高い酸濃度が開始ステップの速度を低下させることが提案されたが、酸触媒作用は、伝播ステップの加速および/または連鎖停止の遅延を伴う。光分解性のHofmann–Löffler–Freytag反応に対する特定の酸性溶媒の影響もNealeとその同僚によって研究されました。
中級者
H 2 SO 4中でのジブチルクロロアミンの分解からの4-クロロジブチルアミンの単離により、δ-クロロアミンの中間性が確認されました。酸性溶液を塩基性にすると、δ-クロラミンが環化して環状アミンと塩化物イオンを生成します。
水素移動の選択性
分子内水素原子移動に影響を与える構造的および幾何学的要因を決定するために、Hofmann-Löffler-Freytag反応でいくつかの異なるN-クロロアミンを調べました。次の点に関するデータを取得するために、システムは慎重に選択されました。一次(1°)、二次(2°)、および三次(3°)水素の相対移動傾向。1,5-および1,6-水素転位の相対速度; 制限された形状の環状システムにおける水素転位の設備。
N-クロロブチルアミルアミン13のフリーラジカル分解の調査により、 1°対2°の水素移動を決定することができました。反応条件下で形成されたのは1- n-ブチル-2-メチルピロリジン14のみであり、1- n-アミルピロリジン15は検出されなかったことが報告された。この観察結果は、ラジカル攻撃が1°よりも2°の水素に対して強い優先度を示すという実質的な証拠を提供しました。

n-ブチルイソヘキシルアミン16を用いて、3°対1°の水素移動の傾向を調べました。16を標準反応条件にさらした場合、16の急速な消失が観察されましたが、ピロリジン生成物は分離できませんでした。この結果は、3°水素に対して高い選択性があることを示唆していますが、中間体の第三級クロロ化合物17は急速に加溶媒分解されます。

同様に、 n-アミルイソヘキシルアミンの反応では環状アミンは観察されませんでした。これは、3°対2°の水素移動に対する選択性を示しています。
1,5-および1,6-水素の移動の相対的な容易さを評価するために、 N-クロロメチル-n-ヘキシルアミン18のHofmann–Löffler–Freytag反応からの生成物の定性的研究を実施しました。18のUV触媒分解とそれに続く塩基性化により、1-メチル-2-エチルピロリジン19と1,2-ジメチルピペリジン20の9:1混合物が生成されました。これは、6員環の形成の程度がかなり大きいことを示しています。

水素の分子内転位における幾何学的要件に関して、同一の反応条件下で、メチルシクロヘキシルクロロアミンおよびN-クロロアザシクロヘプタンのUV光触媒分解は、ジブチルクロロアミンの分解よりもはるかにゆっくりと進行することが観察された。これらの発見は、これらの2つのケースでは、一般的な形状が転位の発生に不利であり、分子内水素移動に必要なCδ–H–N結合角を簡単に達成できないことを示しています。
一般的に受け入れられているメカニズム
酸性媒体中で行われるHofmann-Löffler-Freytag反応の最初のステップは、対応するN-ハロゲン化アンモニウム塩22を形成するためのN-ハロゲン化アミン21のプロトン化であると一般に認められています。フリーラジカル連鎖反応では、N-ハロゲン化アンモニウム塩22が窒素-ハロゲン結合のホモリティック開裂を受けて、窒素中心のラジカルカチオン23が生成されます。対照的に、UV光触媒による開始には遊離型のN-ハロアミンと新しく生成された中性窒素ラジカルの急速なプロトン化(このステートメントをサポートする議論については、機構研究に専念するセクションを参照してください)。分子内1,5-水素原子移動により炭素中心ラジカル24が生成され、続いてN-ハロゲン化アンモニウム塩22からハロゲン原子が引き抜かれます。これにより、プロトン化δ-ハロゲン化アミン25が得られ、窒素中心ラジカルカチオン23が再生されます。反応の連鎖担体。塩基で処理すると、25は脱プロトン化され、続いて分子内S N 2反応が起こり、中間体27を介してピロリジン28が生成されます。
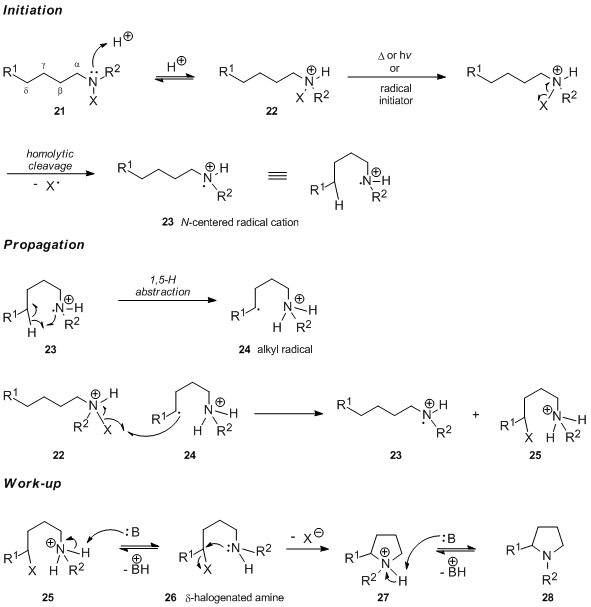
δ-水素原子の優先的な抽象化は、6員の遷移状態に対応し、歪みのないシクロヘキサンチェアタイプのコンフォメーションを採用できます29。

Hofmann–Löffler–Freytag反応は、概念的にはよく知られているバートン反応に関連しています。
反応の一般的な特徴
Hofmann–Löffler–Freytag反応の出発物質は、N-クロロ-、N-ブロモ-、およびN-ヨードアミンである可能性が熱開始の場合、N-ブロモアミンは対応するN-クロロアミンよりも熱的に安定性が低いため、 N-クロロアミンはピロリジンの収率が高くなります。対照的に、開始が照射によって行われる場合、N-ブロモアミンはピロリジンに対してより高い収率を与える。
Hofmann–Löffler–Freytag反応は、もともと酸性条件下で行われていましたが、中性または弱塩基性の条件でもうまく使用できる可能性があることが実証されています。
最初に形成された窒素中心ラジカルは、主にδ位からH原子を引き抜くため、主に5員環が形成されます。
6員環の形成も可能ですが、比較的まれであり、ほとんどの場合、剛直な環状系で観察されます。
アルキルラジカルが、例えば隣接するヘテロ原子による何らかの形の追加の安定化を経験するという条件で、反応はより穏やかな条件下で実施することができる。
ラジカルプロセスは、加熱、光の照射、またはラジカル開始剤(例えば、過酸化物、金属塩)の照射によって開始することができる。
変更と改善
元の強酸性反応条件は、複雑な基質の敏感な官能基および保護基と適合しないことが多いため、Hofmann–Löffler–Freytag反応のいくつかの変更が導入されました。
M.KimuraとY.Banは、隣接する窒素原子がH原子の引き抜きによって生成されたラジカル種を安定化し、このステップを弱塩基性条件下で実行できることを実証しました 環化によって生成された塩化水素を中和するトリエチルアミンの存在。M.KimuraとY.Banは、Hofmann–Löffler–Freytag反応の修正された条件を使用して、ジヒドロデオキシエピアロセルヌイン35を合成しました。

N-ハロアミドの光分解は中性条件下で効率的に進行することが実証されています。N-ブロモアミド36(R =t Bu)の照射は、ブロモメチル-シクロヘキサン-アミド37を生じ、これは、インサイチュでの塩基での処理時に、92%の収率でイミノラクトン38を与えた。

同様に、SWボールドウィンとTJドールは、アルカロイドゲルセミシン41の合成に向けた研究中に、ホフマン-レフラー-フレイタグ反応の変化を調べました。40のピロリジン環の形成は、N-クロロアミド39の照射によって達成されました。

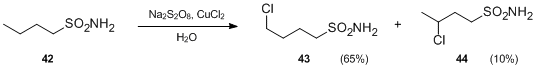
Hofmann–Löffler–Freytag反応の別のバリエーションには、N-ハロアミンの代わりにスルホンアミドが含まれます。過硫酸塩および金属塩の存在下で、スルホンアミドは分子内フリーラジカル官能基化を受けて、中性条件下でγ-およびδ-クロロアルケニルスルホンアミドを生成することができます。例えば、Na 2 S 2 O8およびCuCl2で処理すると、ブチルスルホンアミド42は、酸の非存在下で4-クロロブチルスルホンアミド43および3-クロロブチルスルホンアミド44に変換されました。
Hofmann–Löffler–Freytag反応の最も重要なバリエーションは、Suárez修正です。1980年に、スアレス等。は、 N-ニトロアミドのHofmann–Löffler–Freytag反応に中性条件を使用するプロセスを報告しました。この変換のさらなる開発により、基質の範囲がN-シアナミド、N-ホスホルアミデート、およびカルバメートに拡大しました。 これらの種はすべて、ヨウ素(I 2)の存在下で超原子価ヨウ素試薬と反応し、仮想のヨードアミド中間体のホモリティックフラグメンテーションを介して窒素中心ラジカルを生成します。このように形成されたNラジカルは、非活性化炭素からの分子内1,5-水素引き抜き反応に関与する可能性があり、その結果、ピロリジンが形成されます。

スアレス修飾の大きな利点は、有機合成化学で最も頻繁に使用される保護基の安定性と互換性のある非常に穏やかな中性条件下で反応を実行できることです。その結果、より感度の高い分子でのHofmann–Löffler–Freytag反応の使用が可能になります。この方法論の他の注目すべき特徴は次のとおりです。(1)不安定なヨードアミド中間体がその場で生成されます。(2)ヨードアミドのホモリシスは、低温(20〜40°C)で熱的に進行するか、可視光を照射することで進行します。これにより、UVランプが不要になります。スアレスの修正は、合成において多くのアプリケーションを発見しました(下記参照)。
Nagibと共同研究者は、二次CH結合のアミノ化を可能にするために、スアレス修飾を介してホフマン-レフラー-フレイタグ反応の範囲を拡大する三ヨウ化物戦略を採用しました。このアプローチでは、ラジカル前駆体としてI 2の代わりにNaIを使用して、望ましくないI2を介した分解経路を防止します。他のハロゲン化物塩(NaClやNaBrなど)は、中断されたHofmann–Löffler–Freytagメカニズムの想定される中間体を提供します。
合成におけるアプリケーション
Hofmann–Löffler–Freytag反応の最も一般的な合成ユーティリティは、ピロリジン環の集合です。
標準状態でのHofmann–Löffler–Freytag反応
Hofmann–Löffler–Freytag反応の手順は、伝統的に強酸性条件を必要とし、その魅力を制限します。それにもかかわらず、それは、以下に例示されるように、多種多様な構造的に多様な分子の機能化に首尾よく適用されてきた。
1980年、JPLavergne。etal。はこの方法論を使用してL-プロリン49を調製しました。

PESonnetとJEOliver は、潜在的なアリの性フェロモン前駆体(すなわちオクタヒドロインドリジン51)の合成に古典的なHofmann–Löffler–Freytag反応条件を採用しました。

標準的なHofmann–Löffler–Freytag方法論による二環式アミンの構築の別の例は、アザビシクロオクタン誘導体53のWaegellの合成です。
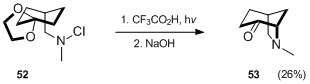
Hofmann–Löffler–Freytag反応を使用して、コブシン型アルカロイドの調製に有用な中間体である(±)-6,15,16-イミノポドカルパン-8,11,13-トリエン55の架橋窒素構造を合成しました。二環式クロロアミン54から。窒素雰囲気下、室温で5時間、トリフルオロ酢酸中の400W高圧水銀ランプで54を照射すると、中程度の収率の生成物が得られた。

アダマンタンの誘導体も、Hofmann–Löffler–Freytag反応を使用して調製されています。 N-クロロアミン56を硫酸と熱で処理すると、2-アダマンタノンが形成されましたが、25°Cで1時間、低圧水銀ランプを使用して、硫酸と酢酸の混合物中で56が光分解しました。所望の生成物57の良好な収率(85%)を与えた。57の環化はかなりの困難を示したが、強制条件下(290℃で10分間加熱)で最終的に34%の収率で達成された。
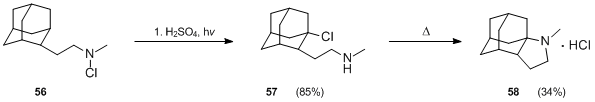
同様に、60などのジアザ-2,6アダマンタンの誘導体は、標準的なホフマン-レフラー-フレイタグ反応条件下で形成される可能性があることが実証されています 。ただし、歩留まりは中程度です。

RPDeshpandeとURNayak は、Hofmann–Löffler–Freytag反応がロンギホレン核を含むピロリジンの合成に適用できることを報告しました(例:62)。

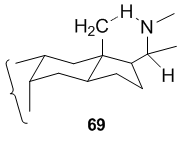
Hofmann–Löffler–Freytag反応の優れた用途は、ステロイドアルカロイド誘導体の調製に見られます。J.Hora およびG.vande Woude は、以下に示すコネシン誘導体の合成にこの手順を使用しました。

64および66の場合、5員窒素環は、C-20に適切に配置された窒素中心ラジカルによる前駆体の非活性化C-18メチル基(それぞれ63または65)への攻撃によって形成されます。この反応の容易さは、剛直なステロイド骨格において、β-C-18メチル基と窒素ラジカルを運ぶβ-C-20側鎖が1,5を可能にするために空間に適切に配置されているという事実によるものです。 -6員遷移状態を介して進行する水素引き抜き。
穏やかな条件下でのHofmann–Löffler–Freytag反応
中性条件下でのHofmann–Löffler–Freytag反応の多くの例が、元の反応条件の変更と改善に専念するセクションに示されています。したがって、このセクションの主な焦点は、Hofmann–Löffler–Freytag反応のSuárez修正の適用です。
Hofmann–Löffler–Freytag反応のSuárez修正は、H。Togoetal。によって開発された新しい合成法の基礎でした。 著者らは、さまざまなN-アルキルサッカリン(N-アルキル-1,2-ベンズイソチアゾリン-3-オン-1,1,-ジオキシド)77が、Nの反応によって中程度から良好な収率で容易に調製されることを実証しました。 -タングステンランプの照射下でヨウ素の存在下でPhI(OAc)2を有する-アルキル(o-メチル)アレーンスルホンアミド70。1,5- o-メチル基の水素引き抜き/ヨウ素化は3回繰り返され、その後、ジヨード中間体76に環化され、その後加水分解されます。

γ位に芳香環を有する第一級アミドのスルホンアミドを、タングステンランプの照射下で様々なヨウ素およびヨウ素で処理すると、非常に興味深い変換が観察されます。この反応は、1,2,3,4-テトラヒドロキノリン誘導体をもたらし、6員環芳香族アミンの優れた調製方法です。例えば、スルホンアミド78は、分子内ラジカル環化を受けて、比較的良好な収率で79を与える。

同じ手順により、3,4-ジヒドロ-2,1-ベンゾチアジン-2,2-ジオキシド81が、スルホンナミジルラジカルを介してN-アルキル2-(アリール)エタンスルホンアミドから得られる。

E.スアレス他 は、中型のラクタム、たとえばPhI(OAc)2とヨウ素の存在下で82の光分解によって生成されるアミジルラジカル中間体が、環状水素引き抜きを受けて、オキソインドリジジンなどの分子内機能化化合物を生成することを報告しました83。

E.スアレスと共同研究者は、キラルな8-オキサ-6-アザビシクロ-オクタン85および7-オキサ-2-アザビシクロヘプタン87環の合成にも彼らの方法論を適用しました。システム。この反応は、 N-アミドラジカルによって促進される分子内1,5-水素引き抜きと、それに続く一時的なC-ラジカル中間体のオキシカルベニウムイオンへの酸化を経て、その後にトラップされる分子内N-グリコシド化と見なすことができます。内部求核試薬。

Hofmann–Löffler–Freytag反応のSuárez修飾の有用性は、多くのステロイドおよびトリテルペン化合物の合成への応用によって実証されました。 以下に示すように、ホスホルアミデートで開始される官能基化は、一般に、N-ニトロまたはN-シアナミドが関与する反応よりも高い収率で進行します。

2008年にBaranetal 。は、Hofmann–Löffler–Freytag反応の変種を使用して1,3-ジオールを合成するための新しい方法を報告しました。

2017年、Nagibetal 。 は、Hofmann–Löffler–Freytag反応の変種を使用して1,2-アミノアルコールを合成し、アルコールのβ選択的CHアミノ化を促進する新しい方法を報告しました。2020年に、非対称バリアントが同じチームによって開示されました。

も参照してください
フリーラジカル反応
バートン反応
参考文献
^ Majetich、G .; Wheless、K.(1995)。「リモート分子内フリーラジカル機能化:最新情報」。四面体。51(26):7095–7129。土井:10.1016 / 0040-4020(95)00406-X。
^ ホフマン、AW(1879)。””Zur Kenntniss des PiperidinsundPyridins””。Ber。Dtsch。化学。ゲス。12(1):984–990。土井:10.1002/cber.187901201254。
^ ホフマン、AW(1881)。「UeberdieEinwirkungdes BromsinalalkisherLösungaufAmide」。Ber。Dtsch。化学。ゲス。14(2):2725–2736。土井:10.1002/cber.188101402242。
^ ホフマン、AW(1883)。「UeberdieEinwirkungdes BromsinalkarishcherLösungaufdieAmine」。Ber。Dtsch。化学。ゲス。16(1):558–560。土井:10.1002/cber.188301601120。
^ Hofmann、AW(1885)。””Zur KenntnissderConiin-Gruppe””。Ber。Dtsch。化学。ゲス。18(1):5–23。土井:10.1002/cber.18850180103。
^ Hofmann、AW(1885)。””Zur KenntnissderConiin-Gruppe””。Ber。Dtsch。化学。ゲス。18(1):109–131。土井:10.1002/cber.18850180126。
^ Lellmann、E.(1890)。「UeberdieConiceïne」。Ber。Dtsch。化学。ゲス。23(2):2141–2142。土井:10.1002/cber.18900230269。
^ Löffler、K .; フライターク、C。(1909年)。””ÜbereienneueBildungsweisevonN-alkoliertenPyrrolidinen””。Ber。Dtsch。化学。ゲス。42(3):3427–3431。土井:10.1002/cber.19090420377。
^ Löffler、K .; コベル、S。(1909)。””ÜberdieBildungdesi-Nicotins aus N-Methyl-p-pyridyl-butylamin(Dihydrometanicotin)””。Ber。Dtsch。化学。ゲス。42(3):3431–3438。土井:10.1002/cber.19090420378。
^ Löffler、K。(1910)。”ÜbereineneueBildungsweiseN-アルキリエターピロリジン”。Ber。Dtsch。化学。ゲス。43(2):2035–2048。土井:10.1002/cber.191004302146。
^ Wawzonek、S .; Thelan、PJ(1950)。「 N-メチルグラナタニンの調製」。混雑する。化学。Soc。72(5):2118–2120。土井:10.1021/ja01161a068。
^ Wawzonek、S .; Thelan、MF Jr; Thelan、PJ(1951)「キヌクリジンの調製」。混雑する。化学。Soc。73(6):2806–2808。土井:10.1021/ja01150a111。
^ Wawzonek、S .; カルバートソン、TP(1959)。「 N-クロロジブチルアミンからの4-クロロジブチルアミンの形成」。混雑する。化学。Soc。81(13):3367–3369。土井:10.1021/ja01522a053。
^ Wolff、ME(1963)。「N-ハロゲン化アミンの環化(ホフマン-レフラー反応)」。化学。改訂63(1):55–64。土井:10.1021/cr60221a004。
^ コーリー、EJ; ハートラー、WR(1960)。「 N-ハロアンモニウムイオンのフリーラジカル鎖分解によるハロアミンと環状アミンの形成に関する研究(Hofmann-Löffler反応)」。混雑する。化学。Soc。82(7):1657–1668。土井:10.1021/ja01492a035。
^ Metcalf、WS(1942)。「モノクロロアミン、ジクロロアミン、トリクロロアミンおよびいくつかの脂肪族誘導体の吸収スペクトル」。J.Chem。Soc。:148〜150。土井:10.1039/JR9420000148。
^ ニール、RS; ウォルシュ、MR; マーカス、NL(1965)。「 N-クロラジアルキルアミンのフリーラジカル転位生成物に対する溶媒およびクロラミン構造の影響」。J.Org。化学。30(11): 3683. doi:10.1021/jo01022a022。
^ コールマン、GH; ゴーヒーン、GE(1938年)。「ピロリジンの調製」。混雑する。化学。Soc。60(3):730. doi:10.1021/ja01270a512。
^ ボールドウィン、南西; 人形、TJ(1979)。「いくつかのゲルセミウムアルカロイドの2-アザ-7-オキサトリシクロウンデカン核の合成」。テトラへドロンレター 20(35):3275–3278。土井:10.1016 / S0040-4039(01)95383-3。
^ Ban、Y .; 木村眞; 大石徹(1976)。「容易なホフマン-レフラー型の光環化の適用による(±)-ジヒドロデオキシエピアロセルヌインの合成」。化学。薬。ブル。24(7):1490–1496。土井:10.1248/cpb.24.1490。
^ 木村眞; バン、Y。(1976)。「1,3-ジアザ複素環の合成。強酸の不在下でのホフマン-ロフラー型の光環化」。合成。1976(3):201–202。土井:10.1055/s-1976-23992。
^ チョウ、YL; Mojelsky、TW; Magdzinski、LJ; Tichy、M.(1985)。「アミドラジカルの化学:アミドラジカル配置に関連する分子内水素引き抜き」。できる。J.Chem。63(8):2197–2202。土井:10.1139/v85-361。
^ ニキシン、GI; Troyansky、EI; ラザレバ、MI(1985)。「アルカンスルホンアミドの位置選択的ワンステップγ-塩素化。スルホニルアミジルラジカルにおけるスルホニル対アミド部分からの1,5-H移動の優位性」。テトラへドロンレター 26(31):3743–3744。土井:10.1016 / S0040-4039(00)89238-2。
^ Hernández、R .; リベラ、A .; サラザール、JA; スアレス、E。(1980)。「非活性炭原子の官能化における中間体としてのニトラミンラジカル」。J.Chem。Soc。、Chem。コミュン。(20):958–959。土井:10.1039/C39800000958。
^ De Armas、P .; フランシスコ、CG; Hernández、R .; サラザール、JA; スアレス、E。(1988)。「ステレオイドN-ニトロアミン。パート4。N-ニトロアミンラジカルの分子内官能化:1,4-ニトロイミン化合物の合成」。J.Chem。Soc。、PerkinTrans。1(12):3255–3265。土井:10.1039/P19880003255。
^ Carrau、R .; Hernández、R .; スアレス、E .; Betancor、C.(1987)。「N-シアナミドラジカルの分子内官能化: 1,4-および1,5- N-シアノエピミノ化合物の合成」。J.Chem。Soc。、PerkinTrans。1:937–943。土井:10.1039/P19870000937。
^ フランシスコ、CG; Herrera、AJ; スアレス、E。(2003)。「炭水化物中のN-ラジカルによって促進される分子内水素引き抜き反応。キラルな7-オキサ-2-アザビシクロヘプタンおよび8-オキサ-6-アザビシクロオクタン環系の合成」。J.Org。化学。68(3):1012-1017。土井:10.1021/jo026314h。PMID12558429。_
^ Betancor、C .; コンセプシオン、JI; Hernández、R .; サラザール、JA; スアレス、E。(1983)。「アミジルホスフェートラジカルによる非活性化炭素の分子内官能化。1,4-エピミン化合物の合成」。J.Org。化学。48(23):4430–4432。土井:10.1021/jo00171a066。
^ De Armas、P .; Carrau、R .; コンセプシオン、JI; フランシスコ、CG; Hernández、R .; スアレス、E。(1985)。「1,4-エピミン化合物の合成。ヨードソベンゼンジアセテート、中性窒素ラジカル生成のための効率的な試薬」。テトラへドロンレター 26(20):2493–2496。土井:10.1016 / S0040-4039(00)94862-7。
^ A.、Wappes、Ethan; C.、Fosu、Stacy; C.、Chopko、Trevor; A.、Nagib、David(2016年8月16日)。「二次C-H結合の三ヨウ化物媒介δ-アミノ化」。アンゲヴァンテケミーインターナショナルエディション。55(34):9974–9978。土井:10.1002/anie.201604704。ISSN1521-3773。_ PMC5166987。_ PMID27384522。_ ^ Titouani、SL; Lavergne、JP; Viallefont、P .; Jacquier、R.(1980)。「Nouvellessynthèsesdel-amino-acids—I:Synthèsestèréospécifiquedel-proline、cis(trans)méthyl-3(4)l-prolines」。四面体。36(20–21):2961–2965。土井:10.1016 / 0040-4020(80)88020-3。
^ ソネット、PE; オリバー、JE(1975)。「昆虫の道標フェロモンの合成:異性体の3-ブチル-5-メチルオクタヒドロインドリジン」。J.複素環式化合物。化学。12(2):289–294。土井:10.1002/jhet.5570120215。
^ Esposito、G .; Furstoss、R .; Waegell、B.(1971)「合成デラメチル-6、アザ-6、ビシクロ(3,2,1)オクタノン-4」。テトラへドロンレター 12(14):899–902。土井:10.1016 / S0040-4039(01)96584-0。
^ 柴沼醤油; 岡本徹(1985)。「ジテルペンアルカロイドへの合成アプローチ:コブシンの架橋アザ二環式環系の構築」。化学。薬。ブル。33(8):3187–3194。土井:10.1248/cpb.33.3187。
^ ナラヤナン、VL; Setescak、L.(1971)「1-メチルアダマンタノピロリジン、新規複素環系の合成」。J.Org。化学。33(26):4127–4129。土井:10.1021/jo00825a026。
^ Dupeyre、RM; ラサット、A。(1973)。「アプリケーション・デ・ラ・リアクション・デ・ホフマン-レフラー-フレイタグ合成デは、ジアザ-2,6アダマンタンを誘導します」。テトラへドロンレター 14(29):2699–2701。土井:10.1016 / S0040-4039(01)96116-7。
^ Deshpande、RP; ナヤック、UR(1979)。IndianJ.Chem。17:310。
^ Hora、J .; Sorm、F.(1968)。「ステロイドについて。CXIV。18-ジメチルアミノ-3β-ヒドロキシ-5α-アンドロスタン-17-オンとその5β-異性体の合成」。ChemPlusChem。33(7):2059–2065。土井:10.1135/cccc19682059。
^ Van De Woude、G .; van Hove、L.(1973)。「アミノステロイド–コナニンおよびヘテロコナニン誘導体」。ブル。Soc。チム。ベルギー。82(1–2):49–62。土井:10.1002/bscb.19730820105。
^ Van De Woude、G .; ヴァンホーブ、L。(1975)。「アミノステロイド– 12酸素化コナニン誘導体の調製(ジヒドロホラレニンの部分合成)」。ブル。Soc。チム。ベルギー。84(10):911–922。土井:10.1002/bscb.19750841001。
^ Van De Woude、G .; Biesemans、M .; van Hove、L.(1980)。「アミノステロイド–プレグナン系の18位からHofmann-Löfflerプロセスによる20位の機能化。5α-ヘテロコナン-3β-オールの主な形成」。ブル。Soc。チム。ベルギー。89(11):993–1000。土井:10.1002/bscb.19800891109。
^ トーゴ、H .; Katohgi、M .; 横山正明(1998)。「 (ジアセトキシヨード)アレーンを用いたN-メチル(o-メチル)アレーンスルホンアミドからのサッカリン骨格の直接調製」。Synlett。1998(2):131–132。土井:10.1055/s-1998-1615。
^ Katohgi、M .; トーゴ、H .; 山口健一; 横山正明(1999)。「 N-アルキル(o-メチル)アレーンスルホンアミドからの1,2-ベンズイソチアゾリン-3-オン-1,1-ジオキシドおよび1,2-ベンズイソチアゾリン-3-オン-1-オキシドへの新しい合成方法」。四面体。55(52):14885–14900。土井:10.1016 / S0040-4020(99)00974-6。
^ トーゴ、H .; Hoshina、Y .; 村木徹; 中山秀樹; 横山正明(1998)。「(Diacyloxyiodo)arenesによる芳香環へのラジカルアミド化に関する研究」。J.Org。化学。63(15):5193–5200。土井:10.1021/jo980450y。
^ トーゴ、H .; 原田恭子; 横山正明(2000)。「(ジアセトキシヨード)アレーンを用いたN-メチル2-(アリール)エタンスルホンアミドからの3,4-ジヒドロ-2,1-ベンゾチアジン2,2-ジオキシド骨格の調製」。J.Org。化学。65(3):926–929。土井:10.1021/jo991419e。
^ ドルタ、RL; フランシスコ、CG; スアレス、E。(1989)。「中型ラクタムの経環状官能基化における超原子価有機ヨウ素試薬:1-アザビシクロ化合物の合成」。化学。コミュン。(16):1168–1169。土井:10.1039/C39890001168。
^ Hernández、R .; メディナ、MC; サラザール、JA; スアレス、E .; Prangé、T。(1987)。「ラクタムにつながるアミドの分子内官能化」。テトラへドロンレター 28(22):2533–2536。土井:10.1016 / S0040-4039(00)95460-1。
^ バラン、PS; Chen、K .; リヒター、JM(2008)。「制御されたラジカル媒介C-H官能化による1,3-ジオール合成」。混雑する。化学。Soc。130(23):7247–7249。土井:10.1021/ja802491q。PMID18481847。_
^ Wappes、Ethan A .; 中福、コーキM .; Nagib、David A.(2017年8月2日)。「ラジカルリレーシャペロンを介したアルコールの直接βC–Hアミノ化」。アメリカ化学会誌。139(30):10204〜10207。土井:10.1021/jacs.7b05214。ISSN0002-7863。_ PMC5940001。_ PMID28741940。_ ^ ステートマン、リアM .; Wappes、Ethan A .; 中福、コーキM .; エドワーズ、カラM .; ナギブ、デビッドA.(2019年2月27日)。「イミデートラジカルリレーを介した触媒的βC–Hアミノ化」。化学科学。10(9):2693–2699。土井:10.1039/C8SC05685D。ISSN2041-6539。_ PMC6419930。_ PMID30996986。_ ^ 中福、コーキM .; 張、Zuxiao; Wappes、Ethan A .; ステートマン、リアM .; チェン、アンドリューD .; ナギブ、デビッドA.(2020年6月22日)。「β-アミノアルコールの合成のためのエナンチオ選択的ラジカルC–Hアミノ化」。ネイチャーケミストリー。12(8):697–704。土井:10.1038/s41557-020-0482-8。ISSN1755-4349。_ PMC7390680。_ PMID32572164。_ S2CID219976955。_ “