Sialic_acid
シアル酸は、9炭素骨格を持つアルファケト酸糖のクラスです。 (ギリシャから用語「シアル酸」唾液、σίαλον -サイアロンは)によって最初に導入されたスウェーデンの生化学グンナー・ブリックス1952年にこのグループの最も一般的なメンバーであるN -acetylneuraminic酸(Neu5Acで又はNANA)の中に見出さ動物といくつかのprokaryotes。
シアル酸は動物組織に広く分布しており、関連する形態は、一部の微細藻類、細菌、古細菌などの他の生物ではそれほど見られません。 シアル酸は通常、糖タンパク質、糖脂質、またはガングリオシドの一部であり、細胞または可溶性タンパク質の表面の糖鎖の末端を装飾します。しかしながら、シアル酸はショウジョウバエの胚や他の昆虫でも観察されています。一般的に、植物はシアル酸を含んでいないか、表示していないようです。
人間の場合、脳はシアル酸の含有量が最も高く、これらの酸はシナプス形成における神経伝達とガングリオシド構造に重要な役割を果たします。 50種類以上のシアル酸が知られており、そのすべてがノイラミン酸の分子からそのヒドロキシル基の1つのアミノ基を置換することによって得ることができます。一般に、アミノ基はアセチル基またはグリコリル基のいずれかを持っていますが、他の修飾が記載されています。これらの修飾と結合は、組織特異的で発生的に調節された発現であることが示されているため、それらのいくつかは、特定の細胞の特定のタイプの複合多糖にのみ見られます。ヒドロキシル置換基はかなり異なる場合がアセチル、ラクチル、メチル、サルフェート、およびホスフェート基が発見されています。
コンテンツ
1 構造
2 生合成3 関数 4 免疫 5 代謝
6 脳の発達
7 病気
7.1 NANS遺伝子の変異を伴うシアル酸欠乏症 7.2 サッラ病 7.3 アテローム性動脈硬化症 7.4 インフルエンザ
8 原核生物中のシアル酸およびその他の非ウロソン酸(NulOs)
9 も参照してください
10 参考文献
11 外部リンク
構造
シアル酸ファミリーには、9炭素糖ノイラミン酸の多くの誘導体が含まれていますが、これらの酸が自然界で遊離しているように見えることはめったにありません。通常、それらは、ムチン、糖タンパク質、および糖脂質のオリゴ糖鎖の成分として見出され、それらが非常に露出し、重要な機能を発達させる外膜および内膜領域の両方で、複雑な炭水化物の非還元位置を占めます。

炭素原子の番号付けは、カルボン酸炭素から始まり、鎖に沿って続きます。カルボン酸塩を軸方向の位置に配置する構成は、アルファアノマーです。
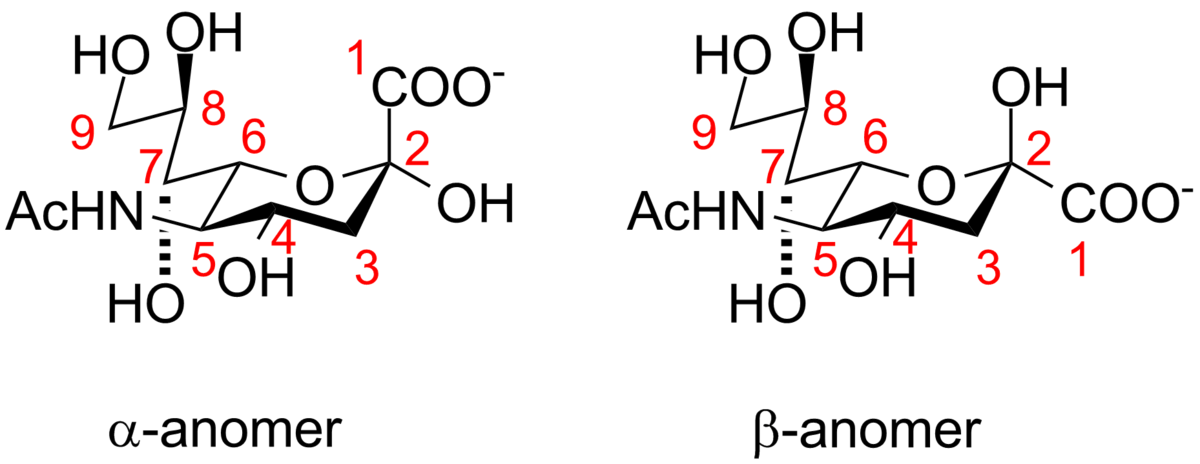
アルファアノマーは、シアル酸がグリカンに結合したときに見られる形態です。ただし、溶液では、主に(90%以上)ベータアノマーの形になっています。シアル酸の溶液を約90%ベータ/ 10%アルファの静止平衡位置に迅速に平衡化することができる、シアル酸ムタロターゼ活性を有する細菌酵素、NanMが発見された。
動物とは対照的に、人間は遺伝的にシアル酸変異体N-グリコリルノイラミン酸(Neu5Gc)を生成することができません。しかし、ヒト組織で検出された少量のNeu5Gcは、外因性(栄養素)源から取り込まれる可能性が
生合成
シアル酸は、グルコサミン6-リン酸によって合成されたアセチルCoAを介しトランスフェラーゼで、その結果、Nのアセチルグルコサミン-6-P。これはエピマー化によりN-アセチルマンノサミン-6-Pになり、ホスホエノールピルビン酸と反応してN-アセチルノイラミン-9-P(シアル酸)を生成します。それが細胞のオリゴ糖生合成プロセスに入るのに活性になるために、シチジン三リン酸に由来する一リン酸ヌクレオシドが加えられ、シアル酸をシチジン一リン酸-シアル酸(CMP-シアル酸)に変える。この化合物は動物細胞の核で合成されます。
細菌系では、シアル酸はアルドラーゼによって生合成することもできます。この酵素は、例えばマンノース誘導体を基質として使用し、ピルビン酸から得られるシアル酸構造に3つの炭素を挿入します。これらの酵素は、シアル酸誘導体の化学酵素的合成に使用できます。
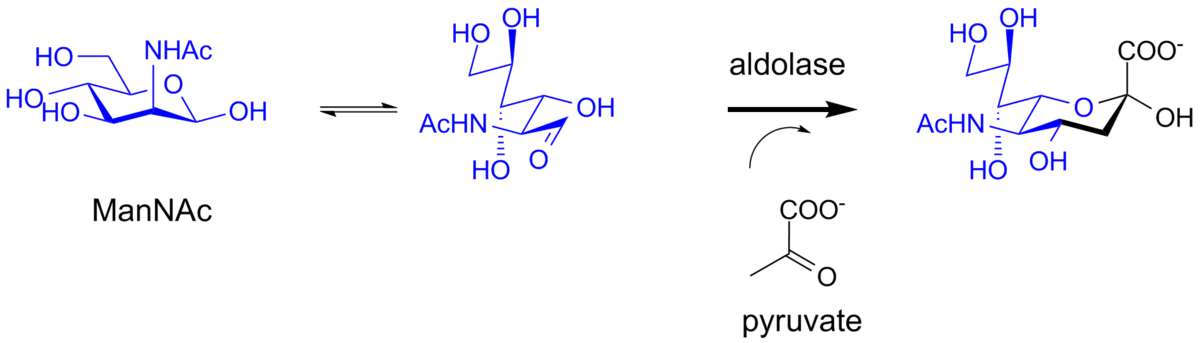
関数
シアル酸含有糖タンパク質(シアロ糖タンパク質)は、ヒトや他の生物のセレクチンに結合します。転移性癌細胞は、しばしば高密度のシアル酸に富む糖タンパク質を発現します。表面でのシアル酸のこの過剰発現は、細胞膜に負の電荷を生成します。これにより、細胞間に反発が生じ(細胞の反対)、これらの後期がん細胞が血流に入るのを助けます。最近の実験では、癌が分泌する細胞外マトリックスにシアル酸が存在することが示されています。
表面膜に見られる複合糖質(糖脂質、糖タンパク質、プロテオグリカン)上のシアル酸に富むオリゴ糖は、細胞の表面に水分を保持するのに役立ちます。シアル酸が豊富な領域は、細胞の表面に負電荷を生成するのに貢献します。水は両方の水素原子に部分的に正電荷を持つ極性分子であるため、細胞表面と膜に引き付けられます。これは、細胞液の取り込みにも寄与します。
シアル酸は、宿主細胞または細菌の表面にあるマンノース抗原をマンノース結合レクチンから「隠す」ことができます。これは補体の活性化を防ぎます。
ポリシアル酸の形のシアル酸は、神経細胞接着分子(NCAM)で発生する異常な翻訳後修飾です。シナプス、ポリシアル酸防止の強い負電荷が細胞の架橋NCAM。
去勢されたマウスへのエストロゲンの投与は、膣のシアル酸含有量の用量依存的な減少をもたらします。逆に、マウスの膣のシアル酸含有量は、エストロゲンの効力の尺度です。参照物質は、エストラジオール皮下投与とのためのエチニルエストラジオールの経口投与のため。
免疫
シアル酸は、脊椎動物と一部の無脊椎動物のすべての細胞表面、および脊椎動物と相互作用する特定の細菌にも見られます。
Ad26 血清型のアデノウイルス(Adenoviridae)、ロタウイルス(Reoviridae)、インフルエンザウイルス(Orthomyxoviridae)などの多くのウイルスは、標的宿主細胞に結合するために宿主シアル化構造を使用できます。シアル酸は高度に保存されており、事実上すべての細胞に大量に存在するため、これらのウイルスの優れた標的となります。当然のことながら、シアル酸はいくつかのヒトウイルス感染症でも重要な役割を果たしています。インフルエンザウイルスの表面には、ヒト赤血球の表面や上気道の細胞膜に見られるシアル酸に結合する血球凝集素活性(HA)糖タンパク質がこれは、ウイルスが血球と混合されるときの血球凝集、および上気道の細胞へのウイルスの侵入の基礎です。広く使用されている抗インフルエンザ薬(オセルタミビルとザナミビル)は、ウイルス酵素ノイラミニダーゼを阻害することにより、感染細胞からの新たに生成されたウイルスの放出を妨げるシアル酸類似体です。
一部の細菌は、結合と認識のためにホストシアル化構造を使用します。たとえば、証拠は、遊離シアル酸が肺炎球菌などの特定の細菌へのシグナルとして振る舞う可能性があることを示しています。遊離シアル酸は、細菌がコロニー形成に適した脊椎動物環境に到達したことを認識するのに役立つ可能性が5位のN-グリコリル基や側鎖のO-アセチル基などのSiasの修飾は、細菌のシアリダーゼの作用を低下させる可能性が
代謝
シアル酸の合成と分解は、細胞のさまざまな区画に分布しています。合成はサイトゾルで始まり、N-アセチルマンノサミン6リン酸とホスホエノールピルビン酸がシアル酸を生成します。その後、Neu5Ac 9リン酸は、CMP-Neu5Acシンターゼを介してシチジル一リン酸(CMP)残基によって核内で活性化されます。シアル酸と他の化合物との間の結合はα結合である傾向がありますが、この特定のものはβ結合である唯一のものです。次に、CMP-Neu5Acは小胞体またはゴルジ装置に輸送され、そこでオリゴ糖鎖に転移して、新しい複合複合糖になります。この結合は、O-アセチル化またはO-メチル化によって修飾することができます。複合複合糖が成熟すると、細胞表面に輸送されます。
シアリダーゼは、シアル酸異化の最も重要な酵素の一つです。それは、細胞表面または血清シアロ複合糖質からのシアル酸残基の除去を引き起こす可能性が通常、高等動物では、分解されやすい複合複合糖がエンドサイトーシスによって捕捉されます。後期エンドソームとリソソームの融合後、リソソームシアリダーゼはシアル酸残基を除去します。これらのシアリダーゼの活性は、O-アセチル基の除去に基づいています。遊離シアル酸分子は、リソソームの膜を介してサイトゾルに輸送されます。そこで、それらはリサイクルされ、再び活性化されて、ゴルジ装置内で別の新生複合複合分子を形成することができます。シアル酸はまた、細胞質ゾル酵素アシルニューラミネートリアーゼでアシルマンノサミンおよびピルビン酸に分解することができる。
いくつかの重篤な疾患は、シアル酸代謝に関連するいくつかの酵素の有無に依存する可能性がシアリドーシスとに突然変異を有するシアル酸欠乏のNaNの遺伝子(下記参照)の障害のこのタイプの例であろう。
脳の発達
シアル酸の機能を研究している科学者は、シアル酸が速い脳の成長に関連しているかどうか、そしてそれが脳の発達に利点をもたらすかどうかを決定しようとしています。母乳には高レベルのシアル酸複合糖質が含まれていることが実証されています。実際、ある研究では、未熟児、および生後5か月の満期母乳で育てられた乳児は、人工乳で育てられた乳児よりも多くの唾液シアル酸を持っていたことが示されています。ただし、母乳のシアル酸含有量は、遺伝的遺伝や授乳などによって異なります。調査は、母乳で育てられた子供と母乳で育てられていない子供に対するシアル酸の影響の比較に焦点を当てています。脳の発達は複雑ですが、すぐに起こります。2歳になると、子供の脳は成人の体重の約80%に達します。子供は完全な数の脳ニューロンを持って生まれますが、それらの間のシナプス接続は出生後に詳しく説明されます。シアル酸は、適切な脳の発達と認知に不可欠な役割を果たしており、必要なときに子供が十分な量を供給できることが重要です。NANS欠損症などのシアル酸合成の遺伝性疾患は、脳の発達に悪影響を与える可能性があります(以下を参照)。
人間の脳は他の哺乳類の脳よりも多くのシアル酸を持っていることが実証されています(2〜4倍)。神経膜は他の細胞膜の20倍のシアル酸を持っています。シアル酸は、ニューロン間の神経伝達を可能にする上で決定的な役割を果たしていると考えられています。学習と記憶行動に対するシアル酸補給の効果は、げっ歯類と子豚(脳の構造と機能が人間のものに非常に似ている)で研究されています。
シアル酸を補給したラットの子は、成体としての学習と記憶の改善を示しました。シアル酸が豊富な飼料が新生子豚に5週間与えられた。次に、迷路の中で視覚的な手がかりを使用して、学習と記憶を評価しました。食事によるシアル酸補給と認知機能との関係が見られました。高用量のシアル酸を与えられた子豚は、より早く学習し、ミスを少なくしました。これは、シアル酸が脳の発達と学習に影響を及ぼしていることを示唆しています。

インフルエンザウイルスがエンドサイトーシスによって細胞に侵入する方法
病気
シアル酸は、人間に見られるいくつかの異なる病気に関連しています。
NANS遺伝子の変異を伴うシアル酸欠乏症
ヒトのシアル酸合成遺伝子であるN-アセチルノイラミン酸シンターゼ(NANS)の二対立遺伝子劣性変異は、知的障害と低身長を特徴とする重篤な疾患を引き起こす可能性があり、脳の発達におけるシアル酸の重要性を強調しています。経口投与されたシアル酸の短期補給による治療試験は、生化学的パラメーターに対する有意な有益な効果を示すことができませんでした。
サッラ病
サッラ病は非常にまれな病気であり、遊離シアル酸蓄積障害の最も軽度の形態と考えられていますが、その小児期の形態は攻撃的な変種と見なされ、それに苦しむ人々は精神遅滞を持っています。これは6番染色体の突然変異によって引き起こされる常染色体劣性疾患です。それは主に神経系に影響を及ぼし、リソソーム膜にある特定のシアル酸担体の欠乏に起因するリソソーム蓄積の不規則性によって引き起こされます現在、この病気の治療法はなく、治療は、症状の制御に焦点を当てた支援的です。
アテローム性動脈硬化症
アテローム性動脈硬化症の原因となるLDLコレステロールのサブフラクションは、シアル酸のレベルが低下しています。これらには、小さな高密度LDL粒子と電気陰性LDLが含まれます。小さな高密度LDL粒子のシアル酸レベルが低下すると、動脈壁のプロテオグリカンに対するこれらの粒子の親和性が高まります。
インフルエンザ
すべてのA型インフルエンザウイルス株は、細胞と接続するためにシアル酸を必要とします。A型インフルエンザウイルスとの親和性が異なるシアル酸にはさまざまな形態がこの多様性は、どの種が感染する可能性があるかを決定する重要な事実です。特定のインフルエンザAウイルスがシアル酸受容体によって認識されると、細胞はウイルスをエンドサイトーシスする傾向があるため、細胞は感染します。
原核生物中のシアル酸およびその他の非ウロソン酸(NulOs)
シアル酸は、多くの異なる生物学的プロセスに関与している脊椎動物の組織に非常に豊富に含まれています。もともと動物の後口動物系統内で発見されたシアル酸は、実際には、ノヌロソン酸(NulOs)と呼ばれる9炭素骨格単糖のより古いファミリーのサブセットと見なすことができ、最近では真正細菌と古細菌でも発見されています。多くの病原菌は、リポ多糖や莢膜多糖などの細胞表面の特徴にシアル酸を組み込んでおり、宿主の自然免疫応答を回避するのに役立ちます。最近のゲノムレベルの研究では、シーケンスされた微生物ゲノムの大規模なセットが調査され、非ウロソン酸(NulO)を生成する生合成経路が、以前に実現されていたよりもはるかに広く系統樹全体に分布していることが示されました。この発見はさらに、最近のレクチン染色研究および原核生物の非ウロソン酸に関する分子レベルの調査によって裏付けられており、多くの非病原性で純粋な環境株も細菌性シアル酸(NulO)を産生することを示しています。 一部(アナモックス)細菌はNulOsを生成することも非常に酸性アルファ-ケト酸基表示に加えて、(中和)塩基性基(遊離アミン)。同等の細胞表面シアル酸は、C1の負に帯電したカルボキシル基を中和するC5で遊離アミンを生成することによって細胞表面電荷を操作するための化学リモデリングによって生成されています。
も参照してください
シアリドーシス
シアロ糖タンパク質
シアリルトランスフェラーゼ
オルトミクソウイルス科
参考文献
^ Varki、Ajit; ローランドシャウアー(2008)。「シアル酸」。Essentials ofGlycobiologyで。コールドスプリングハーバープレス。pp。Ch。14. ISBN 9780879697709。
^ Wagstaff、ベン(2018)。「ハプト藻PrymnesiumparvumにおけるKdn生合成経路の同定は、微細藻類の間での広範なシアル酸生合成を示唆している」。Journal of BiologicalChemistry。293(42):16277–16290。土井:10.1074 /jbc.RA118.004921。PMC 6200933。PMID 30171074。 ^ Ajit、Varki(2017)。「シアル酸および他の非ウロソン酸」。シアル酸および他の非ウロソン酸。 “糖生物学の要点。コールドスプリングハーバーラボラトリープレス。
^ Kleikamp、ヒューゴー(2020)。「微生物のノヌロソン酸の化学的多様性への取り組み–普遍的な大規模調査アプローチ」。化学科学。11(11):3074〜3080。土井:10.1039 / c9sc06406k。PMC 8157484。PMID 34122812。 ^ ルイス、アマンダ(2009)。「非ウロソン酸構造の系統発生学的予測によって明らかにされた宿主および微生物のシアル酸生合成における革新」。国立科学アカデミーの議事録。106(32):13552–13557。Bibcode:2009PNAS..10613552L。土井:10.1073 /pnas.0902431106。PMC 2726416。PMID 19666579。 ^ シャウアー、ローランド(2018)。「シアル酸の世界の探検」。Adv Carbohydr ChemBiochem。炭水化物化学と生化学の進歩。75(75):1–213。土井:10.1016 /bs.accb.2018.09.001。ISBN 9780128152027。PMC 7112061。PMID 30509400。
^ Wang、B。; Brand-Miller、J。(2003)「人間の栄養におけるシアル酸の役割と可能性」。European Journal of ClinicalNutrition。57(11):1351–1369。土井:10.1038 /sj.ejcn.1601704。PMID 14576748。 ^ Mandal、C。(1990)。「シアル酸結合レクチン」。経験。46(5):433–441。土井:10.1007 / BF01954221。PMID 2189746。S2CID 27075067。 ^ Varki、Ajit; ローランドシャウアー(2008)。「シアル酸」。Essentials ofGlycobiologyで。コールドスプリングハーバープレス。pp。Ch。14. ISBN
9780879697709。
^ Schauer R.(2000)。「シアル酸研究の成果と課題」。Glycoconj。J。17(7–9):485–499。土井:10.1023 / A:1011062223612。PMC 7087979。PMID 11421344。 ^ Severi E、MüllerA、Potts JR、Leech A、Williamson D、Wilson KS、Thomas GH(2008)。「シアル酸の変旋光は、大腸菌のベータプロペラタンパク質YjhTによって触媒されます」。J BiolChem。283(8):4841–91。土井:10.1074 /jbc.M707822200。PMID 18063573。 ^ Tangvoranuntakul、Pam(2003年10月14日)。「免疫原性の非ヒト食餌性シアル酸のヒトへの取り込みと取り込み」。PNAS。100(21):12045〜12050。Bibcode:2003PNAS..10012045T。土井:10.1073 /pnas.2131556100。PMC 218710。PMID 14523234。 ^ Fulcher CA、「MetaCycキメラ経路:シアル酸とCMP-シアル酸生合成のスーパー経路」、「MetaCyc、2009年3月」 ^ ウォーレン、レナード; フェルセンフェルド、ハーバート(1962年)。「シアル酸の生合成」(PDF)。Journal of BiologicalChemistry。237(5):1421 DOI:10.1016 / S0021-9258(19)83718から3。
^ Hai Yu; Harshal Chokhawala; Shengshu Huang&Xi Chen(2006)。「天然および非天然の官能基を含むシアロシドの合成へのワンポット3酵素化学酵素的アプローチ」。ネイチャープロトコル。1(5):2485–2492。土井:10.1038 /nprot.2006.401。PMC 2586341。PMID 17406495。 ^ Fuster、Mark M。; Esko、Jeffrey D.(2005)。「癌の甘酸っぱい:新しい治療標的としてのグリカン」。ネイチャーレビューがん。5(7):526–42。土井:10.1038 / nrc1649。PMID 16069816。S2CID 10330140。 ^ Dasgupta、Debayan; パリー、ダルマ; サイニ、ディーパック; バート、ラムレイ; ゴーシュ、アンバレーシュ(2020)。「ナノモーターは腫瘍微小環境における局所的な物理化学的不均一性を感知する」。アンゲヴァンテケミー。59(52):23690–23696。土井:10.1002 /anie.202008681。PMC 7756332。PMID 32918839。 ^ ユルゲンサンドウ; Ekkehard Scheiffele; マイケル・ヘリング; ギュンターニーフ; Klaus Prezewowsky; Ulrich Stache(2007)、「Hormones」、Ullmann’s Encyclopedia of Industrial Chemistry(7th ed。)、Wiley、pp。1–81、doi:10.1002 / 14356007.a13_089、ISBN 978-3527306732 ^ ベイカー、アレクサンダーT。; マンディ、ロージーM。; デイビス、ジェームスA。; Rizkallah、Pierre J。; パーカー、アランL.。「ヒトアデノウイルス26型は、一次細胞侵入受容体としてシアル酸含有グリカンを使用します」。サイエンスアドバンシス。5(9):eaax3567。土井:10.1126 /sciadv.aax3567。PMC 6726447。PMID 31517055。 ^ Varki A。; Gagneux P.(2012)。「免疫におけるシアル酸の多様な役割」。Ann NY AcadSci。1253(1):16–36。Bibcode:2012NYASA1253 … 16V。土井:10.1111 /j.1749-6632.2012.06517.x。PMC 3357316。PMID 22524423。 ^ トラビング、C。; Schauer、R。(1998)。「シアル酸の構造、機能および代謝」。細胞および分子生命科学。54(12):1330–1349。土井:10.1007 / s000180050258。PMC 7082800。PMID 9893709。 ^ Oliveros E、VázquezE、Barranco A、RamírezM、Gruart A、Delgado-GarcíaJM、Buck R、Rueda R、MartínMJ(2018)。「授乳中のシアル酸とシアル化オリゴ糖の補給は、ラットの学習と記憶を改善します」。栄養素。10(10):E1519。土井:10.3390 / nu10101519。PMC 6212975。PMID 30332832。 ^ Wang B.(2012)。「脳の発達と認知に不可欠な栄養素としてのシアル酸の根底にある分子メカニズム」。アドバンス Nutr。3(3):465S–472S。土井:10.3945 /an.112.001875。PMC 3649484。PMID 22585926。 ^ van Karnebeek、Clara DM; ボナフェ、ルイーザ; 文暁燕; Tarailo-Graovac、Maja; バルザノ、サラ; Royer-Bertrand、ベリル; アシコフ、天使; ガラヴェリ、リビア; マンミ、イザベラ; Turolla、Licia; ブリーン、キャサリン。「NANSを介したシアル酸の合成は、脳と骨格の発達に必要です」。ネイチャージェネティクス。48(7):777–784。土井:10.1038 /ng.3578。ISSN 1546年から1718年。PMID 27213289。S2CID 24953080。 ^ Tran C、Turolla L、Ballhausen D、Buros SC、Teav T、Gallart-Ayala H、Ivanisevic J、Faouzi M、Lefeber DJ、Ivanovski I、Giangiobbe S、Caraffi SG、Garavelli L、Superti-Furga A.経口投与されたシアル酸:N-アセチルノイラミン酸シンターゼ欠損症の患者と対照被験者からの最初の洞察。Mol GenetMetabRep。20216月26日; 28:100777。土井:10.1016 /j.ymgmr.2021.100777。PMID:34258226; PMCID:PMC8251509。
^ 「サッラ病|遺伝性および希少疾患情報センター(GARD)–NCATSプログラム」。
^ 「無料のシアル酸貯蔵病」。Orphanet 。
^ Ponsot、G。(2007)。「Enfermedadespordepósitodeácidosiálicolibre:enfermedad de Salla(incluida su forma infantil grave)ysialuria」。EMC-Pediatría(スペイン語)。42:1–3。土井:10.1016 / S1245-1789(07)70257-3。
^ 「Enfermedadespordepósitodeácidosiálicolibre:Enfermedad de Salla(incluida su forma infantil grave)y sialuria」(スペイン語)。
^ Ivanova EA、Myasoedova VA、Melnichenko AA、Grechko AV、Orekhov AN(2017)。「アテローム性動脈硬化症のバイオマーカーとしての低密度低密度リポタンパク質」。酸化医学と細胞寿命。2017(10):1273042. DOI:10.1155 / 1273042分の2017。PMC 5441126。PMID 28572872。 ^ Racaniello、Vincent(2009年5月5日)。「インフルエンザウイルスの細胞への付着:異なるシアル酸の役割」。ウイルス学ブログ。
^ Ajit、Varki(2015)。「シアル酸および他の非ウロソン酸」。シアル酸および他の非ウロソン酸、Essentials of Glycobiology(第3版)。第15章:コールドスプリングハーバー(NY):コールドスプリングハーバーラボラトリープレス。pp。2015–2017。
^ Severi E。; フードDW; トーマスGH(2007)。「細菌性病原体によるシアル酸の利用」。微生物学。153(9):2817–2822。土井:10.1099 / mic.0.2007 / 009480-0。PMID 17768226。 ^ アマンダ、ルイス(2009)。「非ウロソン酸構造の系統発生学的予測によって明らかにされた宿主および微生物のシアル酸生合成における革新」。国立科学アカデミーの議事録。106(32):13552–13557。Bibcode:2009PNAS..10613552L。土井:10.1073 /pnas.0902431106。PMC 2726416。PMID 19666579。 ^ Kleikamp、ヒューゴー(2020)。「微生物のノヌロソン酸の化学的多様性への取り組み–普遍的な大規模調査アプローチ」。化学科学。11(11):3074〜3080。土井:10.1039 / C9SC06406K。PMC 8157484。PMID 34122812。 ^ Boleij、Marissa(2020年3月31日)。「アナモックスハウスの装飾:アナモックス粒状スラッジの細胞外高分子物質中のシアル酸と硫酸化グリコサミノグリカン」。環境。科学 テクノル。54(8):5218–5226。Bibcode:2020EnST … 54.5218B。土井:10.1021 /acs.est.9b07207。PMC 7181257。PMID 32227885。 ^ パブスト、マーティン; グルズデフ、デニスS。; ローソン、クリストファーE。; Kleikamp、ブリティッシュコロンビア州ヒューゴ; デラム、キャロル; ルーウェン、ロジェ; リン・ユゥメイ; リュッカー、セバスチャン; van Loosdrecht、Mark CM; ラウレニ、ミケーレ(2021-08-02)。「原核生物のタンパク質のグリコシル化を探索するための一般的なアプローチは、アナモックス細菌のユニークな表面層変調を明らかにします」。ISME Journal:1–12。土井:10.1038 / s41396-021-01073-y。ISSN 1751から7370まで。PMID 34341504。 ^ 王、傑; チェン、ボー; リー、ジエ; チャン、チャオユエ; ホン、ウェイヤオ; チェン、シン; Chen、Peng R.(2015)。「パラジウム誘発生体直交脱離反応による細胞表面シアル酸の化学的リモデリング」。アンゲヴァンテケミーインターナショナルエディション。54(18):5364–5368。土井:10.1002 /anie.201409145。ISSN 1521から3773まで。
外部リンク
進化におけるシアル酸”