Tyrosine_aminotransferase
チロシンアミノトランスフェラーゼ(またはチロシントランスアミナーゼ)は肝臓に存在する酵素であり、チロシンの4-ヒドロキシフェニルピルビン酸への変換を触媒します。
チロシントランスアミナーゼ
ピリドキサールリン酸と複合体を形成した ヒトチロシンアミノトランスフェラーゼ(虹色、
N末端=青、
C末端=赤)( 空間充填モデル)。
識別子
EC番号
2.6.1.5
CAS番号
9014-55-5
データベース IntEnz IntEnzビュー
ブレンダ
BRENDAエントリー ExPASy NiceZymeビュー KEGG KEGGエントリー MetaCyc 代謝経路
プリアモス
プロフィール
PDB構造
RCSB PDB PDBe PDBsum
遺伝子オントロジー
AmiGO / QuickGO索 PMC
記事 PubMed 記事 NCBI タンパク質 TAT 利用可能な構造 PDB オーソログ検索:PDBe RCSB
PDBIDコードのリスト 3DYD 識別子
エイリアス
TAT、Tat、チロシンアミノトランスフェラーゼ
外部ID
OMIM:613018 MGI:98487 HomoloGene:37293 GeneCards:TAT
EC番号
2.6.1.5
遺伝子の位置(ヒト) Chr。 16番染色体(ヒト)
バンド 16q22.2 始める
71,565,660 bp
終わり
71,577,092 bp
遺伝子の位置(マウス) Chr。 8番染色体(マウス)
バンド
8 D3 | 8 57.38 cM
始める
109,990,437 bp
終わり
109,999,803 bp
RNA発現パターン Bgee トップ表現
肝臓の右葉
肝臓
多細胞生物
外側広筋 腱 その他の参照発現データ BioGPS 該当なし
遺伝子オントロジー
分子機能
トランスフェラーゼ活性
アミノ酸結合
トランスアミナーゼ活性
触媒活性
L-チロシン:2-オキソグルタル酸アミノトランスフェラーゼ活性
ピリドキサールリン酸結合
GO:0001948タンパク質結合
細胞成分
サイトゾル
ミトコンドリア
細胞成分
生物学的プロセス
有機環状化合物への応答
細胞のアミノ酸代謝プロセス
糖質コルチコイドへの反応
L-フェニルアラニン異化過程
生合成プロセス
2-オキソグルタル酸代謝プロセス
酸化ストレスへの反応
芳香族アミノ酸ファミリーの代謝過程
チロシン異化過程
グルタミン酸代謝プロセス
水銀イオンへの反応
芳香族アミノ酸ファミリーの異化プロセス
出典:Amigo / QuickGO
オーソログ
種族
人間
ねずみEntrez6898 234724 Ensembl ENSG00000198650 ENSMUSG00000001670 UniProtP17735 Q8QZR1
RefSeq(mRNA)NM_000353 NM_146214
RefSeq(タンパク質)NP_000344 NP_666326
場所(UCSC)
Chr 16:71.57 – 71.58 Mb
Chr 8:109.99 – 110 Mb
PubMed検索
ウィキデータ
人間の表示/
マウスの表示/
L-チロシン+
2-オキソグルタル酸 ⇌ { rightleftharpoons}
4-ヒドロキシフェニルピルビン酸+
L-グルタミン酸
ヒトでは、チロシンアミノトランスフェラーゼタンパク質はTAT 遺伝子によってコードされています。ヒトにおける酵素の欠乏は、II型高チロシン血症として知られるものをもたらす可能性があり、チロシンがアミノトランスフェラーゼ反応を受けて4-ヒドロキシフェニルピルビン酸を形成できない結果として、チロシンが豊富に存在します。
コンテンツ
1 機構
2 活性部位
3 病理学
4 参考文献
5 外部リンク
機構
チロシンアミノトランスフェラーゼ酵素によって触媒される化学反応に関与する3つの主要な分子の構造を以下に示します:アミノ酸チロシン、補欠分子族 ピリドキサールリン酸、および結果として生じる生成物4-ヒドロキシフェニルピルビン酸。


チロシンアミノトランスフェラーゼ二量体のリボン図
。補欠分子族PLPは両方のモノマーに見られ
二量体タンパク質の各側には、チロシンアミノトランスフェラーゼ分子のLys280残基に結合したピリドキサールリン酸(PLP)が含まれています。チロシンのアミン基は、Lys280に結合したイミンのアルファ炭素を攻撃し、四面体複合体を形成してから、LYS-ENZを開始します。このプロセスは、PLPに結合したイミン基を切り替える行為による遷移として知られています。次に、新しく形成されたPLP-TYR分子が塩基によって攻撃されます。

PLPにリンクされたTATアミノ酸Lys280のボール&スティック図。
メカニズムの塩基の可能性のある候補は、PLPから押し出されたばかりのLys280である可能性があり、PLP-TYR分子の新しく形成されたアミノ基を隔離します。アスパラギン酸トランスアミナーゼの同様のメカニズムでは、PLPの最初のイミンを形成するリジンは、後で、トランスイミネーションでチロシンを攻撃する塩基として機能します。プロトンの喪失によって残された電子は下に移動してイミンへの新しい二重結合を形成します。これにより、すでに二重結合された電子がPLPを介して押し出され、6員の正に帯電した窒素上で孤立電子対になります。分子の環。水はPLP-TYRのイミンのアルファ炭素を攻撃し、アシル置換によってPLPの窒素を開始し、ピリドキサミンリン酸(PMP)と4-ヒドロキシフェニルピルビン酸を形成します。
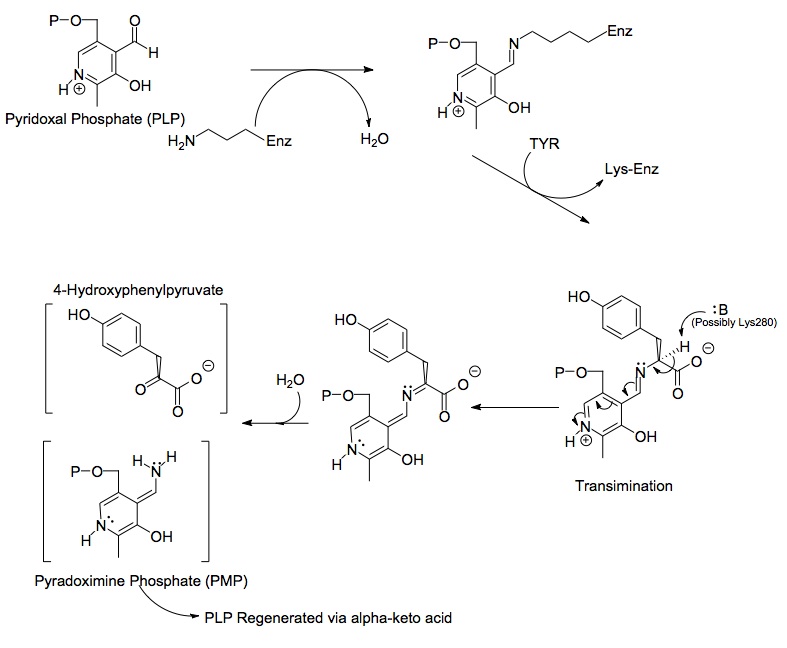
次に、PMPは、そのアミン基をα-ケトグルタル酸に転移し、そのアルデヒド官能基を再形成することにより、PLPに再生されます。これに続いて、Lys280残基との別の置換反応が行われ、酵素へのイミン結合が再形成され、ENZ-PLPが形成されます。
活性部位

非極性アミノ酸側鎖Phe169およびIle249を描いた空間充填モデル。PLPを正しい方向に保持するための2つのグループのサンドイッチ効果に注意してください
二量体としてのチロシンアミノトランスフェラーゼは、2つの同一の活性部位を持っています。Lys280はPLPに結合しており、PLPは2つの非極性アミノ酸側鎖を介して所定の位置に保持されています。フェニルアラニンとイソロイシン(右のサムネイルを参照)。PLPは、主にそのリン酸基によって周囲の分子に水素結合することによっても所定の位置に保持されます。
以下に示すのは、3つの異なる倍率での1つの活性部位です。

病理学
チロシン血症は、チロシンアミノトランスフェラーゼに関連する最も一般的な代謝性疾患です。この病気は、肝臓のチロシンアミノトランスフェラーゼの欠乏に起因します。 II型チロシン血症(Richner-Hanhart症候群、RHS)は、角膜炎、掌蹠過角化症、精神遅滞、および血中チロシンレベルの上昇を特徴とする常染色体劣性遺伝の疾患です。チロシン血症II型患者の角膜炎は、角膜へのチロシン結晶の沈着によって引き起こされ、角膜の炎症を引き起こします。 TAT遺伝子はヒト染色体16q22-24に位置し、12個のエクソンを含む10.9キロベース(kb)を超えて広がり、その3.0 kbmRNAは50.4kDaの454アミノ酸タンパク質をコードします。 12の異なるTAT遺伝子変異が報告されている。
参考文献
^ PDB:3DYD ; Karlberg T、Moche M、Andersson J、他 (2008)。「ヒトチロシンアミノトランスフェラーゼ」。公開予定。
^ GRCh38:Ensemblリリース89:ENSG00000198650 – Ensembl、2017年5月 ^ GRCm38:Ensemblリリース89:ENSMUSG00000001670 – Ensembl、2017年5月 ^ 「HumanPubMedリファレンス:」。米国国立バイオテクノロジー情報センター、米国国立医学図書館。
^ 「マウスPubMedリファレンス:」。米国国立バイオテクノロジー情報センター、米国国立医学図書館。
^ ディートリッヒJB(1992年4月)。「チロシンアミノトランスフェラーゼ:とりわけトランスアミナーゼ?」。細胞および分子生物学。38(2):95–114。PMID 1349265。 ^ Zea-Rey、Alexandra V。; Cruz-Camino、Héctor; Vazquez-Cantu、Diana L。; Gutiérrez-García、Valeria M。; サントス-グズマン、イエス; Cantú-Reyna、Consuelo(2017年11月27日)。「メキシコの人口における一過性の新生児チロシン血症の発生率」。先天性代謝異常症とスクリーニングのジャーナル。5:232640981774423. DOI:10.1177 / 2326409817744230。
^ Rettenmeier R、Natt E、Zentgraf H、Scherer G(1990年7月)。「ヒトチロシンアミノトランスフェラーゼ遺伝子の単離と特性化」。核酸解像度。18(13):3853–61。土井:10.1093 / nar /18.13.3853。PMC 331086。PMID 1973834。 ^ ペッターセン、EF; ゴダード、TD; 黄、CC; ソファ、GS; Greenblatt、DM; 孟、EC; フェリン、TE(2004)。「UCSFキメラ-探索的研究と分析のための視覚化システム」。計算化学ジャーナル。25(13):1605–1612。CiteSeerX 10.1.1.456.9442。土井:10.1002 /jcc.20084。PMID 15264254。S2CID 8747218。 ^ Natt E、Kida K、Odievre M、Di Rocco M、Scherer G(1992年10月)。「高チロシン血症II型におけるチロシンアミノトランスフェラーゼ遺伝子の点突然変異」。手順 国立 Acad。科学 アメリカ。89(19):9297–301。Bibcode:1992PNAS … 89.9297N。土井:10.1073 /pnas.89.19.9297。PMC 50113。PMID 1357662。 ^ al-Hemidan AI、al-Hazzaa SA(1995年3月)。「リッチナー-ハンハート症候群(高チロシン血症II型)。症例報告と文献レビュー」。眼科遺伝子。16(1):21–6。土井:10.3109 / 13816819509057850。PMID 7648039。 ^ 南堀M、石田山本A、加藤N、高橋H、飯塚H。「リッチナー-ハンハート症候群:チロシンアミノトランスフェラーゼの新規変異を伴う症例の報告」。J.ダーマトール。科学。41(1):82–4。土井:10.1016 /j.jdermsci.2005.10.007。PMID 16318910。
分子グラフィックス画像は、カリフォルニア大学サンフランシスコ校のバイオコンピューティング、視覚化、および情報学のリソース(NIH P41 RR-01081でサポート)のUCSFキメラパッケージを使用して作成されました。
外部リンク
米国国立医学図書館のMedicalSubject Headings(MeSH)のチロシン+アミノトランスフェラーゼ
PDBe-KBは、ヒトチロシンアミノトランスフェラーゼのPDBで利用可能なすべての構造情報の概要を提供します
![]()
生物学ポータル”