Tyrosine_kinase
チロシンキナーゼである酵素で転送することができるリンからグループをATPにチロシン特定の残基のタンパク質を細胞内。これは、多くのセルラー機能で「オン」または「オフ」スイッチとして機能します。
プロテインチロシンキナーゼ pdb 2HCK、PyMOLでレンダリング
識別子
シンボルkinase_Tyr Pfam F07714 InterPro PR001245
頭いいyrKc PROSITE DOC00629 SCOP2
1apm / SCOPe / SUPFAM
OPMスーパーファミリー 186 OPMタンパク質k1k CDD d00192
メンブラノーム 3 利用可能なタンパク質構造:
Pfam
構造/ ECOD PDB RCSB PDB ; PDBe ; PDBj PDBsum 構造の概要
チロシンキナーゼは、プロテインキナーゼとして知られるより大きなクラスの酵素に属しており、セリンやスレオニンなどの他のアミノ酸にもリン酸を結合します。キナーゼによるタンパク質のリン酸化は、細胞内のシグナルを伝達し(シグナル伝達)、細胞分裂などの細胞活動を調節するための重要なメカニズムです。
プロテインキナーゼは変異し、「オン」の位置に留まり、細胞の無秩序な成長を引き起こす可能性がこれは、癌の発症に必要なステップです。したがって、イマチニブなどのキナーゼ阻害剤は、多くの場合、効果的な癌治療です。
ほとんどのチロシンキナーゼには、リン酸基を除去する関連タンパク質チロシンホスファターゼが
コンテンツ
1 反応2 関数 3 規制
3.1 赤血球 3.2 その他の例
4 構造
5 家族
5.1 受容体 5.2 細胞質/非受容体
6 臨床的な意義
6.1 非小細胞肺がん 6.2 慢性骨髄性白血病 6.3 消化管間質腫瘍
7 阻害剤
7.1 GISTとイマチニブ 7.2 慢性骨髄性白血病とニロチニブ 7.3 その他
8 例
9 も参照してください
10 参考文献
11 外部リンク
反応

アクティベーションプロセスの図。
プロテインキナーゼは、ガンマ(末端)リン酸をヌクレオシド三リン酸(多くの場合ATP)からタンパク質基質側鎖の1つまたは複数のアミノ酸残基に転移する触媒サブユニットを有する酵素のグループであり、タンパク質機能に影響を与えるコンフォメーション変化をもたらします。酵素は、基質特異性に関して特徴づけられる2つの広いクラスに分類されます:セリン/スレオニン特異的、およびチロシン特異的(の主題)。
関数
キナーゼは、ATPなどのヌクレオシド三リン酸供与体から受容体分子へのホスホリル基の転移を触媒する酵素の大きなファミリーです。チロシンキナーゼは、タンパク質のチロシン残基のリン酸化を触媒します。チロシン残基のリン酸化は、次に、それらが含まれているタンパク質の機能に変化を引き起こします。
チロシン残基でのリン酸化は、酵素活性、細胞内局在、分子間の相互作用など、タンパク質の幅広い特性を制御します。また、チロシンキナーゼは、多くの中で機能するシグナル伝達細胞外シグナルを介して送信されるカスケード細胞膜に細胞質にしばしば及び核遺伝子発現を改変することができます。最後に、突然変異はいくつかのチロシンキナーゼを構成的に活性化させる可能性があり、これは癌の開始または進行に寄与する可能性のあるノンストップの機能状態です。
チロシンキナーゼは、さまざまなプロセス、経路、および作用で機能し、体内の重要なイベントに関与しています。受容体型チロシンキナーゼは膜貫通シグナル伝達で機能しますが、細胞内のチロシンキナーゼは核へのシグナル伝達で機能します。核内のチロシンキナーゼ活性には、細胞周期の制御と転写因子の特性が関係しています。このように、実際には、チロシンキナーゼ活性は有糸分裂、または細胞内の有糸分裂の誘導に関与しています。サイトゾルのタンパク質と核のタンパク質は、このプロセス中にチロシン残基でリン酸化されます。細胞の成長と生殖は、ある程度チロシンキナーゼに依存している可能性がチロシンキナーゼ機能は、クロマチンではなく核膜と、DNAを物理的に安定化するのに役立つ「繊維状ウェブ」を含む核マトリックスで観察されています。具体的には、核マトリックスで同定されたSrcファミリーのキナーゼの一種であるLynは、細胞周期を制御しているようです。Srcファミリーのチロシンキナーゼは密接に関連していますが、さまざまな機能を示します。Srcファミリーのチロシンキナーゼの役割または発現は、細胞の種類によって、また細胞の成長と分化の際に大きく異なります。 LynおよびSrcファミリーのチロシンキナーゼは一般に、シグナル伝達経路で機能することが知られています。 Lynが細胞膜に局在しているという証拠がリンは、物理的および機能的にさまざまな受容体分子と関連しています。
線維芽細胞(細胞外マトリックスとコラーゲンを合成し、創傷治癒に関与する細胞の一種)は、ポリオーマウイルスによって形質転換されており、細胞マトリックスでより高いチロシン活性を持っています。さらに、チロシンキナーゼ活性は、細胞の形質転換と相関していることが確認されています。チロシン上のミドルT抗原のリン酸化は、細胞の成長または生殖と同様の変化である細胞の形質転換にも関連していることも実証されています。
機械的な力と調節信号の伝達は、生物の正常な生存において非常に基本的です。プロテインチロシンキナーゼもこのタスクで役割を果たします。pp125と呼ばれるプロテインチロシンキナーゼは、前記キナーゼの免疫蛍光局在によって示されるように、細胞の焦点接着の影響において手元にある可能性が高い。フォーカルアドヒージョンは、機械的な力と調節信号の伝達に機能する高分子構造です。科学界では、pp125は、細胞の接着斑に前述のように存在するため、FAK(接着斑キナーゼ)とも呼ばれます。プロテインチロシンキナーゼpp125は、影響を受けていない(形質転換されていない)鳥類およびげっ歯類の線維芽細胞における主要なホスホチロシン含有タンパク質の1つです(線維芽細胞は上記で詳細に説明されています)。線維芽細胞は、動物の創傷治癒と細胞構造に関与する細胞型であり、他の比較的マイナーではあるが重要な仕事の中でも、頻繁にまたは時折発生します。National Biomedical Research FoundationおよびGenBankデータベースと比較した場合のpp125の配列と構造は非常にユニークである可能性があり、プロテインチロシンキナーゼファミリーの新しいメンバーである可能性がこのプロテインチロシンキナーゼは、他のいくつかのプロテインチロシンキナーゼと比較して最大約70%ユニークであり、確立されたプロテインチロシンキナーゼファミリーの実際のメンバー間の数値とは異なります。また、間接的に観察されたアミノ酸配列は、それが細胞質に関連していることを示しており、細胞質タンパク質チロシンキナーゼの大きなグループの1つと呼ばれています。モノクローナル抗体がそれを認識するのが観察されたときに発見されました。 pp60v-srcによって形質転換されたニワトリ胚細胞からのモノクローナル抗体は、7つの異なるホスホチロシン含有タンパク質を認識します。 2A7と名付けられたこれらのモノクローナル抗体の1つは、pp125を認識し、pp125が実際にはプロテインチロシンキナーゼであるという考えを支持しています。
上でいくらか詳細に説明されているように、細胞増殖は、ある部分でチロシンキナーゼに依存している可能性がある。チロシンキナーゼ機能は核マトリックスで観察されています。核マトリックスで最初に発見されたキナーゼのタイプであるLynは、分化中のカルシウム誘発性ケルチノサイトの核に含まれる可能性のあるチロシンキナーゼのSrcファミリーの一部です。核マトリックス中のリンは、核膜とDNAを物理的に安定化させる「繊維状ウェブ」の中で、マトリックスと関連して機能していることがわかりました。また、それは細胞周期を条件としているように見えた。しかしながら、核マトリックス内の総チロシンキナーゼ活性に対するLynタンパク質の寄与は不明です。Lynは部分的にしか抽出されなかったため、その活動の正確な測定を管理できませんでした。 Vegesna et al。によれば、そのような兆候はそれ自体である。(1996)、Lynポリペプチドは核マトリックスのチロシンキナーゼ活性と関連しています。抽出されたLynは酵素的に活性であり、この概念をサポートしていました。
プロテインチロシンキナーゼのさらに別の可能性のある、そしてありそうな役割は、ラットのエンドトキシンによって引き起こされる循環不全および臓器機能不全の場合、阻害剤であるチルホスチンおよびゲニステインの効果がプロテインチロシンキナーゼに関与することである。細胞膜の受容体が受け取る周囲の信号は、細胞の細胞質に伝達されます。Bae et al。によると、受容体型チロシンキナーゼによる膜貫通シグナル伝達。(2009)、例えば、SH2タンパク質ドメインによって媒介される相互作用に大きく依存しています。SH2タンパク質ドメインの選択性は、チロシンキナーゼが関与する細胞プロセスを仲介するのに機能的であることが実験によって決定されています。受容体型チロシンキナーゼは、この方法により、成長因子受容体のシグナル伝達に影響を与える可能性がこれは、後生動物のより基本的なセルラー通信機能の1つです。
規制
チロシンキナーゼ酵素が他の要因の影響を受けると、大きな変化が引き起こされることが要因の1つは、リガンドと呼ばれるタンパク質によって可逆的に結合される分子です。多くの受容体型チロシンキナーゼは、確かにすべてではありませんが、これらのリガンドの1つによって占有されるか、活性化されるまで、プロテインキナーゼ活性を実行しません。より多くの研究が受容体がエンドソーム内で活性を維持することを示していますが、リガンドによって引き起こされるエンドサイトーシスが受容体が不活性化されるプロセスの原因であるとかつて考えられていました。活性化された受容体型チロシンキナーゼ受容体は短時間で内在化され(システムに再循環され)、最終的にリソソームに送達され、そこで消化に関与する異化酸性加水分解酵素に隣接して働きます。内在化されたシグナル伝達複合体は、さまざまな受容体型チロシンキナーゼシステムにおいてさまざまな役割を果たしており、その詳細が研究されています。さらに、リガンドは可逆的結合に関与し、阻害剤は非共有結合で結合します(これらの阻害剤が酵素、酵素-基質複合体、またはその両方に結合するかどうかに応じて、異なるタイプの阻害が行われます)。関連する科学研究に携わる一部の人々に特に関心のある属性である多価性は、あるユニットに配置された複数のリガンドが別のユニットのいくつかの一致する受容体に同時に結合することを特徴とする現象です。いずれにせよ、リガンドのパートナーへの結合は、多くのタンパク質の機能に及ぼす影響のために明らかです。リガンド活性化受容体型チロシンキナーゼは、時々呼ばれるように、独特の属性を示します。チロシン受容体キナーゼがそのリガンドに結合すると、細胞のサイトゾルに存在するチロシンキナーゼに結合することができます。
赤血球
動作中のこのトリガーシステムの例は、赤血球の形成が調節されるプロセスです。哺乳類はこのシステムを持っており、これは発生信号が生成される腎臓で始まります。サイトカインとも呼ばれる発生シグナルは、この場合はエリスロポエチンです。(サイトカインは造血細胞の増殖と分化の重要な調節因子です。)エリスロポエチンの活性は、造血サイトカイン受容体が活性化されると開始されます。赤血球の調節において、エリスロポエチンは165個のアミノ酸を含むタンパク質であり、細胞質プロテインキナーゼJAKを活性化する役割を果たします。いくつかの新しい研究の結果は、前述のサイトカイン受容体がJAKチロシンキナーゼファミリーのメンバーとともに機能することも示しています。サイトカイン受容体はJAKキナーゼを活性化します。これにより、細胞膜にあるいくつかのシグナル伝達タンパク質がリン酸化されます。これはその後、リガンドを介した受容体の刺激と細胞内シグナル伝達経路の活性化の両方に影響を及ぼします。 JAKキナーゼの基質は、いくつかの遺伝子応答などを仲介します。このプロセスは、血球の生成を仲介する役割も果たします。この場合、エリスロポエチンは対応する原形質膜受容体に結合し、受容体を二量体化します。二量体は、結合を介してキナーゼJAKを活性化する役割を果たします。エリスロポエチン受容体の細胞質ドメインに位置するチロシン残基は、結果的に活性化プロテインキナーゼJAKによってリン酸化されます。全体として、これは受容体型チロシンキナーゼがリガンドによって活性化されて赤血球形成を調節する方法でも
その他の例
これと同様に、因子の影響を受けたタンパク質チロシンキナーゼ活性の追加の例が存在します。Grb2などのアダプタータンパク質は、受容体プロテインキナーゼの影響下でリン酸チロシン残基に結合します。このメカニズムは、タンパク質間相互作用を引き起こす通常のメカニズムです。
さらに、余分な状況を説明するために、インスリン関連因子がチロシンキナーゼに影響を与えることが決定されています。インスリン受容体基質は、インスリンの効果を調節することによってシグナル伝達において機能する分子です。多くの受容体酵素は、構造と受容体型チロシンキナーゼ活性に密接に関連しており、基本的または典型的な受容体酵素はインスリンであると決定されています。インスリン受容体基質IRS2およびIRS3はそれぞれ、受容体型チロシンキナーゼによって開始される経路のシグナル伝達能力を強化するのに役立つ、独特の特徴的な組織機能および分布を持っています。活性化されたIRS-1分子は、インスリンによって生成されるシグナルを増強します。対照的に、インスリン受容体システムは、エンドソームシグナル伝達の有効性を低下させるようです。
上皮成長因子受容体システムそれ自体は、中間的な例として使用されてきた。この場合、いくつかの信号は実際の細胞表面から生成されますが、他の信号はエンドソーム内から発せられているようです。この多様な機能は、リガンド特異的なシグナルを作り出す手段となる可能性がこれは、mRNA翻訳後のタンパク質の修飾の用語である人身売買が受容体シグナル伝達の機能に不可欠である可能性があるという概念を支持しています。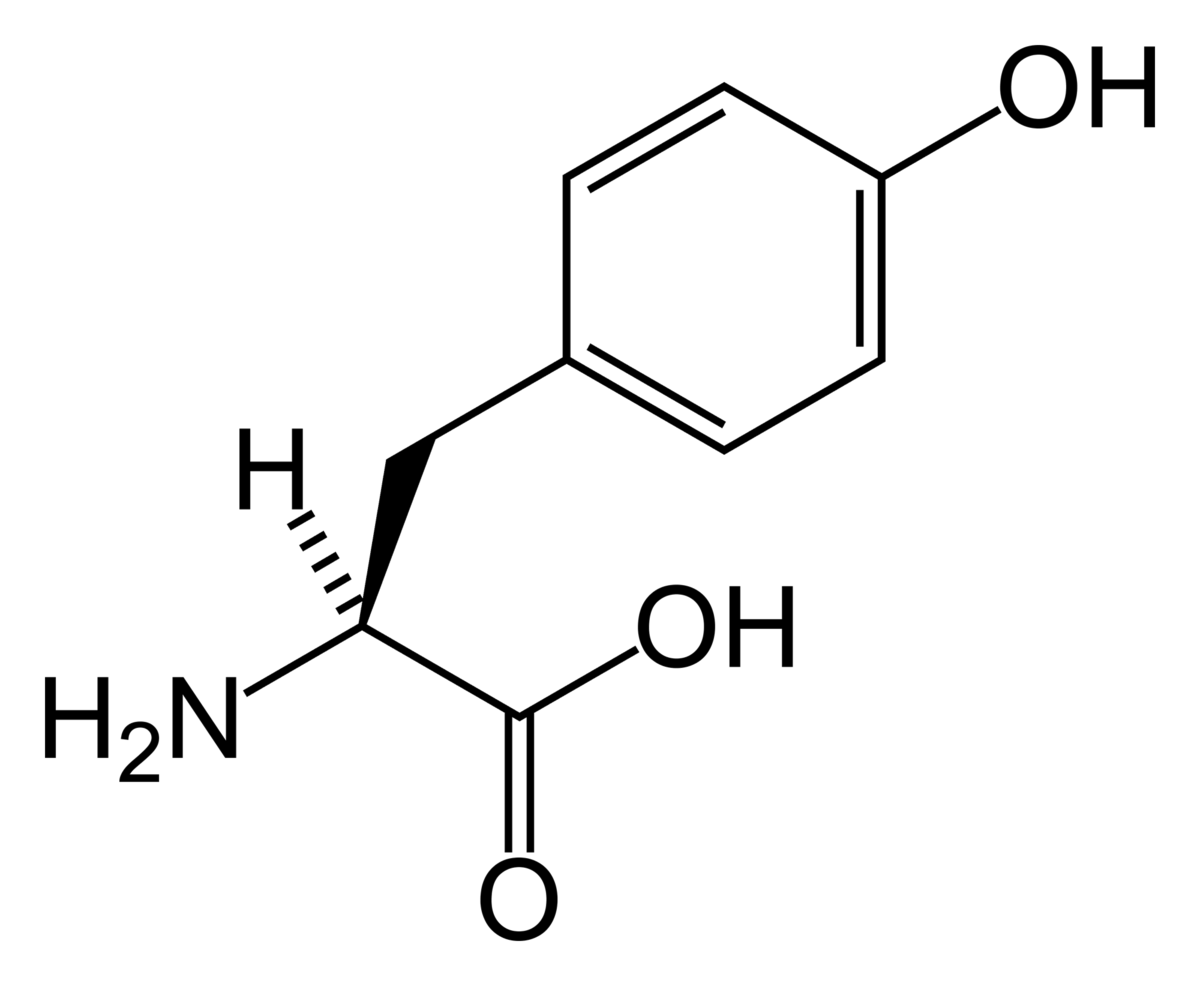
チロシン
リン酸塩

ATP
構造
すべてのプロテインチロシンキナーゼで認識できる多くの構造的特徴には、ATP結合部位が含まれています。これは、3番目のリン酸基(しばしばガンマリン酸基と呼ばれる)の機能に関連すると考えられている3つの残基です。酵素に結合したATP分子、およびアミノ酸である酵素の可能な触媒部位。また、プロテインチロシンキナーゼの間で非常に一般的なのは、2つのペプチド配列です。
Protein DataBankには100を超えるチロシンキナーゼの3D構造が例は、PDB:1IRK、ヒトインスリン受容体のチロシンキナーゼドメインの結晶構造です。
家族
チロシンキナーゼは2つの主要なファミリーに分けられます:
膜貫通受容体連結型キナーゼ
あるものの細胞質タンパク質
90を超えるプロテインチロシンキナーゼ(PTK)がヒトゲノムで発見されています。それらは、受容体型チロシンキナーゼと非受容体型チロシンキナーゼの2つのクラスに分けられます。
受容体
受容体型チロシンキナーゼ
2004年までに、58の受容体型チロシンキナーゼ(RTK)が知られ、20のサブファミリーにグループ化されました。それらは、成長(ニューロトロフィンのシグナル伝達による)、分化、代謝、接着、運動性、死を含む多様な細胞活動において極めて重要な役割を果たします。 RTKは、特定のリガンドに結合できる細胞外ドメイン、膜貫通ドメイン、および選択した基質に結合してリン酸化できる細胞内触媒ドメインで構成されています。リガンドが細胞外領域に結合すると、RTKに一連の構造的再配列が生じ、酵素活性化が起こります。特に、キナーゼドメインのいくつかの部分の動きは、アデノシン三リン酸(ATP)への自由なアクセスと活性部位への基質を与えます。これは、細胞外シグナルを核に最終的に伝達(「伝達」)する細胞内タンパク質のリン酸化を介して一連のイベントを引き起こし、遺伝子発現の変化を引き起こします。多くのRTKは、遺伝子変異または染色体転座によって、あるいは単に過剰発現によって、発癌に関与しています。いずれの場合も、結果は高活性キナーゼであり、これは異常な、リガンド非依存性の、調節されていない成長刺激を癌細胞に与える。
細胞質/非受容体
非受容体型チロシンキナーゼ
ヒトには、32個の細胞質タンパク質チロシンキナーゼがあります(EC 2.7.10.2)。
同定された最初の非受容体型チロシンキナーゼは、v-src 発癌性タンパク質でした。ほとんどの動物細胞には、Srcファミリーのチロシンキナーゼの1つまたは複数のメンバーが含まれています。鶏肉腫ウイルスは、正常な細胞のSrc遺伝子の変異したバージョンを運ぶことが判明しました。変異したv – src遺伝子は、細胞のSRC(c- src)遺伝子に特徴的な酵素活性の通常の組み込み阻害を失っています。SRCファミリーのメンバーは、多くの細胞プロセスを調節することがわかっています。たとえば、T細胞抗原受容体は、Srcと構造的に類似している2つのタンパク質であるLckとFynの活性化によって細胞内シグナル伝達を引き起こします。
臨床的な意義
プロテインキナーゼ阻害剤
チロシンキナーゼは、癌の治療に影響を与えるため、今日特に重要です。特定のチロシンキナーゼを構成的に活性化させる突然変異は、いくつかの癌に関連しています。イマチニブ(商品名GleevecおよびGlivec)は、これらのチロシンキナーゼの触媒的裂け目に結合し、その活性を阻害することができる薬剤です。
チロシンキナーゼ活性は、非常に不利と見なされることもある他のイベントにも大きく関与しています。例えば、酵素の増強された活性は、細胞分裂などの特定のシステムの機能の混乱に関係している。また、アテローム性動脈硬化症や乾癬などの局所炎症、または敗血症や敗血症性ショックなどの全身性炎症に関連する多数の疾患も含まれます。多くのウイルスが感染時にチロシンキナーゼ機能を標的としています。ポリオーマウイルスは、核マトリックス内のチロシンキナーゼ活性に影響を及ぼします。線維芽細胞は、哺乳類細胞の創傷治癒と細胞構造形成に関与する細胞です。これらの細胞がポリオーマウイルスによって形質転換されると、細胞マトリックスでより高いチロシン活性が観察され、これは細胞増殖とも相関しています。チロシンキナーゼを標的とする別のウイルスは、ニワトリに肉腫を引き起こすレトロウイルスであるラウス肉腫ウイルスです。感染した細胞は、非常に珍しい明らかな構造変化と細胞増殖調節を示します。ラウス肉腫ウイルスによってコードされるプロテインチロシンキナーゼは細胞の形質転換を引き起こし、腫瘍性タンパク質と呼ばれます。さらに、チロシンキナーゼは、非小細胞肺がんにつながるような方法で誤って機能することが一般的で広範囲に及ぶがんである非小細胞肺がんは、乳がん、結腸直腸がん、および前立腺がんを合わせた総数よりも多くの人の死因です。
研究によると、タンパク質のリン酸化は、正常細胞の膜貫通型受容体および膜関連タンパク質チロシンキナーゼの両方によって、チロシンの残基で起こることが示されています。リン酸化は、成長因子の数と多様性を調節する細胞シグナル伝達において重要な役割を果たします。これは、ラウス肉腫ウイルスの影響を受けた細胞が明らかな構造変化と正常な細胞増殖調節の完全な欠如を示すという観察によって証明されています。ラウス肉腫ウイルスにコードされた腫瘍性タンパク質は、この細胞の形質転換の原因であり、この細胞の形質転換に必要なタンパク質チロシンキナーゼです。チロシンリン酸化活性はまた、細胞組成および成長調節の変化に関連して増加または減少します。このように、細胞によって示される特定の形質転換は、チロシンキナーゼが示す役割に依存しています。プロテインチロシンキナーゼは、リンパ球の活性化に主要な役割を果たします。さらに、それらは副腎クロム親和性細胞、血小板、神経細胞などの細胞型のコミュニケーション経路を仲介するのに機能的です。
チロシンキナーゼは、突然変異などの議論された影響のために、生物内で無秩序な酵素になる可能性がこの動作は大混乱を引き起こします。重要なプロセスが混乱します。生物が機能不全に依存しているシステムは、しばしば癌を引き起こします。この種の状況を防ぐことは非常に望ましいことです。多くの研究は、根本的に機能するプロテインチロシンキナーゼ酵素の阻害剤が関連する病気に及ぼす重要な効果をすでに指摘しています。(チロシンキナーゼ阻害剤を参照)
非小細胞肺がん
チロシンキナーゼの阻害剤に対する癌の反応は、臨床試験で評価されました。この場合、ゲフィチニブはチロシンキナーゼの阻害剤です。誤ったチロシンキナーゼ機能は、非小細胞肺がんにつながる可能性がゲフィチニブは、上皮成長因子受容体を標的とするチロシンキナーゼ阻害剤であり、非小細胞肺がんの患者に好ましい結果をもたらします。一般的な広範囲の癌である非小細胞肺癌は、乳癌、結腸直腸癌、および前立腺癌を合わせたものよりも多くの人々の死因です。これは、がん治療の潜在的な標的としてチロシンキナーゼ阻害剤の研究を行う強い動機です。上皮成長因子受容体チロシンキナーゼ阻害剤として機能するゲフィチニブは、非小細胞肺癌に関連する症状を改善し、X線写真による腫瘍の退縮をもたらしました。これはそのような阻害剤の有効性の例です。抑制のプロセスは、癌がどのように持続するかを示しています。上皮成長因子受容体の変異は、細胞の生存を促進するシグナル伝達経路を活性化します。非小細胞肺がん細胞は、これらの生存シグナルに依存するようになります。ゲフィチニブによる生存シグナルの阻害は、非小細胞肺がん治療薬としての有効性に寄与する要因である可能性が
ゲフィチニブは人間に十分に耐えられ、治療により、250 mgのゲフィチニブと35%(95%の信頼度)を投与された患者の症状改善率は43%(33%〜53%の間隔で95%の信頼度)になりました。 500mgを投与された患者では26%〜45%の間隔)。この試験では、上皮成長因子受容体は、がんの症状の改善によって示されるように、阻害剤に対して迅速な反応を示しました。各グループにおいて、上皮成長因子受容体チロシンキナーゼ阻害剤治療の1週間後に改善が認められました。ゲフィチニブを1日1回投与すると、非小細胞肺がん患者に「急速な」症状の改善と腫瘍の退縮が引き起こされました。医学研究の分野では、これはチロシンキナーゼ関連の癌を治療するための阻害剤の使用の特に重要な例です。この試験で発見される前に利用できた主要な選択肢は、化学療法、手術、および放射線療法だけでした。1日1回のゲフィチニブ経口治療の副作用は重大であると考えられました。下痢は、250mg群の患者の57%および500mg群の75%で報告されました。 1人の患者はグレード2よりも重度の下痢を患っており、たった1日で最大6回の排便があった。また、おそらく上皮成長因子受容体チロシンキナーゼ阻害剤治療が原因で死亡した。ただし、相関関係は正確には明確ではありません。さらに、250mg群の患者の62%で皮膚毒性が観察された。それにもかかわらず、ゲフィチニブの副作用は「一般的に軽度で、扱いやすく、非累積的で、可逆的」でした。残念ながら、阻害剤の服用をやめることが、好ましくない症状の唯一の逆転戦略である可能性がゲフィチニブは、他のがん治療と比較して、依然としてかなり安全で効果的な治療法です。
さらに、上皮成長因子受容体は、新しい腫瘍の生成である腫瘍形成において重要な役割を果たします。 2010年までに、2つのモノクローナル抗体とエルロチニブと呼ばれる別の小分子チロシンキナーゼ阻害剤も癌を治療するために開発されました。
2013年7月12日FDAは、上皮成長因子受容体(EGFR)変異を有する腫瘍を有する転移性非小細胞肺癌(NSCLC)患者のファーストライン治療のためにアファチニブ「複数受容体、不可逆的TKI」を承認しました
慢性骨髄性白血病
BCR-ABLは、慢性骨髄性白血病に関連する構成的に活性化されたチロシンキナーゼです。9番染色体と22番染色体の断片が壊れて場所を交換するときに融合遺伝子から形成されます。9番染色体のABL遺伝子は22番染色体のBCR遺伝子と結合して、BCR-ABL融合遺伝子を形成します。チロシンキナーゼ活性はBCR-ABLの形質転換に重要です。したがって、それを阻害すると、癌の症状が改善されます。CMLを治療するために現在利用可能な阻害剤には、イマチニブ、ダサチニブ、ニロチニブ、ボスチニブ、およびポナチニブが
消化管間質腫瘍
消化管間質腫瘍(GIST)は、癌の化学療法治療に耐えることが知られており、進行した症例では(2001年に)いかなる種類の治療にも反応しません。ただし、チロシンキナーゼ阻害剤STI571(イマチニブ)は転移性消化管間質腫瘍の患者の治療に効果的です。消化管間質腫瘍は、消化管の結合組織を構成する細胞の前駆細胞から形成される間葉系新生物のクラスターで構成されています。これらの腫瘍のほとんどは胃に見られますが、小腸や腸管の他の場所にあることもこれらの腫瘍の細胞は、チロシンキナーゼ活性に関連する成長因子受容体を持っています。この成長因子受容体はc-kitと呼ばれ、癌原遺伝子(c-kit)によって産生されます。c-kitの変異は、チロシンキナーゼの構成的活性を引き起こし、癌性消化管間質腫瘍を引き起こします。c-kit変異の結果には、無制限のチロシンキナーゼ活性と細胞増殖、c-kitの無秩序なリン酸化、およびいくつかの通信経路の破壊が含まれます。イマチニブによる治療は、消化管間質腫瘍における非正常な細胞シグナル伝達メカニズムを阻害する可能性がこれは、患者に有意な反応をもたらし、持続的な疾病管理をもたらします。2001年までに、この阻害剤が人間に効果的で安全である可能性があることはもはや疑われていませんでした。同様に、プロテインチロシンキナーゼ阻害剤STI571は腫瘍の物理的サイズを大幅に縮小することがわかった。それらは、4か月の試行でサイズが約65%減少し、減少し続けました。新しい病変は現れず、多くの肝転移は完全に減少して存在しなくなった。この研究の1人の患者は、治療後も健康を維持していました。進行した消化管間質腫瘍の効果的な治療法はありませんが、STI571は、好ましくないチロシンキナーゼ活性を阻害することにより、構成的に活性なc-kitに関連する早期がんの効果的な治療法です。
。
阻害剤
チロシンキナーゼ阻害剤
酵素活性を低下させるために、阻害剤分子は酵素に結合します。酵素活性を低下させると、病原体が無効になったり、誤った機能システムが修正されたりする可能性がそのため、多くの酵素阻害剤は、一般の人々が薬物として使用するために開発されています。
GISTとイマチニブ
消化管間質腫瘍(GIST)は、消化管に影響を与える間葉系腫瘍です。治療の選択肢は限られています。しかしながら、機能不全の酵素に対する阻害剤としてのイマチニブは効果的である可能性が
慢性骨髄性白血病とニロチニブ
イマチニブが効かない場合、進行した慢性骨髄性白血病の患者は、ニロチニブ、ダサチニブ、ボスチニブ、ポナチニブ、または白血病を引き起こす機能不全酵素に対する別の阻害剤を使用することができます。この阻害剤は、選択性の高いBcr-Ablチロシンキナーゼ阻害剤です。
その他
スニチニブは、血管内皮増殖因子受容体(VEGFR)、血小板由来増殖因子受容体(PDGFR)、幹細胞因子受容体、およびコロニー刺激因子1受容体に作用する経口チロシンキナーゼ阻害剤です(Burstein et al.2008 )。
ゲフィチニブとエルロチニブは、上皮成長因子受容体(EGFR)のチロシンキナーゼドメインを阻害し、この細胞表面受容体チロシンキナーゼの過剰発現が多い肺および膵臓の癌の治療に使用できます。
キナーゼ阻害剤も媒介することができます。パラクリンシグナル伝達は、上皮成長因子受容体キナーゼ阻害剤への応答を仲介します。パラクリンはアクティブに上皮成長因子受容体における内皮細胞にこれを行うには、腫瘍のを。
ダサチニブは、老化細胞除去薬としても慢性骨髄性白血病の治療薬としても有効なSrcチロシンキナーゼ阻害剤です。
例
このドメインを含むヒトタンパク質には以下が含まれます:
AATK ; ABL ; ABL2 ; ALK ; AXL ; BLK ; BMX ; BTK ; CSF1R ; CSK ; DDR1 ; DDR2 ; EGFR ; EPHA1 ; EPHA2 ; EPHA3 ; EPHA4 ; EPHA5 ; EPHA6 ; EPHA7 ; EPHA8 ; EPHA10 ; EPHB1 ; EPHB2 ; EPHB3 ; EPHB4 ; EPHB6 ; ERBB2 ; ERBB3 ; ERBB4 ; FER ; FES ; FGFR1 ; FGFR2 ; FGFR3 ; FGFR4 ; FGR ; FLT1 ; FLT3 ; FLT4 ; FRK ; FYN ; GSG2 ; HCK ; IGF1R ; ILK ; INSR ; INSRR ; IRAK4 ; ITK ; JAK1 ; JAK2 ; JAK3 ; KDR ; キット; KSR1 ; LCK ; LMTK2 ; LMTK3 ; LTK ; リン; MATK ; MERTK ; MET ; MLTK ; MST1R ; ムスク; NPR1 ; NTRK1 ; NTRK2 ; NTRK3 ; PDGFRA ; PDGFRB ; PLK4 ; PTK2 ; PTK2B ; PTK6 ; PTK7 ; RET ; ROR1 ; ROR2 ; ROS1 ; RYK ; SGK493 ; SRC ; SRMS ; STYK1 ; SYK ; TEC ; TEK ; TEX14 ; TIE1 ; TNK1 ; TNK2 ; TNNI3K ; TXK ; TYK2 ; TYRO3 ; はい1 ; ZAP70
も参照してください
チルホスチン
Bcr-Ablチロシンキナーゼ阻害剤
参考文献
^ ハンクスSK、クインAM、ハンターT(1988年7月)。「プロテインキナーゼファミリー:触媒ドメインの保存された特徴と推定された系統発生」。科学。241(4861):42–52。Bibcode:1988Sci … 241 … 42H。土井:10.1126 /science.3291115。PMID 3291115。
^ l m n o p q Cox、Michael; ネルソン、デビッドR.(2008)。レーニンガー:生化学の原則(第5版)。WHフリーマン・アンド・カンパニーISBN 978-1-4292-2416-1。
^ l m n o Radha V、Nambirajan S、Swarup G(1996年3月)。「Lynチロシンキナーゼと核マトリックスとの関連およびマトリックス関連チロシンキナーゼ活性の細胞周期依存性変化」。European Journal ofBiochemistry。236(2):352–9。土井:10.1111 /j.1432-1033.1996.00352.x。PMID 8612602。 ^ Ruetten H、Thiemermann C(1997年9月)。「ラットのエンドトキシンによって引き起こされる循環不全と臓器機能障害に対するチルホスチンとゲニステインの効果:プロテインチロシンキナーゼの可能な役割」。ブリティッシュジャーナルオブファーマコロジー。122(1):59–70。土井:10.1038 /sj.bjp.0701345。PMC 1564904。PMID 9298529。 ^ Schaller MD、Borgman CA、Cobb BS、Vines RR、Reynolds AB、Parsons JT(1992年6月)。「pp125FAKは、接着斑に関連する構造的に特徴的なタンパク質チロシンキナーゼ」。アメリカ合衆国科学アカデミー紀要。89(11):5192–6。Bibcode:1992PNAS … 89.5192S。土井:10.1073 /pnas.89.11.5192。PMC 49256。PMID 1594631。
^ ngjel J、Kratchmarova I、Blagoev B。「受容体型チロシンキナーゼシグナル伝達:定量的プロテオミクスからの見解」。分子バイオシステム。5(10):1112–21。土井:10.1039 / b909534a。PMID 19756300。 ^ Wiley HS、Burke PM。「エンドサイトーシス輸送による受容体チロシンキナーゼシグナル伝達の調節」。トラフィック。2(1):12–8。土井:10.1034 /j.1600-0854.2001.020103.x。PMID 11208164。S2CID 7329602。 ^ Rinker S、Ke Y、Liu Y、Chhabra R、Yan H。「距離依存性の多価リガンド-タンパク質結合のための自己組織化DNAナノ構造」。ネイチャーナノテクノロジー。3(7):418–22。土井:10.1038 /nnano.2008.164。PMC 2556356。PMID 18654566。 ^ Silvennoinen O、Saharinen P、Paukku K、Takaluoma K、Kovanen P(1997年7月)。「JakチロシンキナーゼおよびStat転写因子を介したサイトカイン受容体シグナル伝達」。APMIS。105(7):497–509。土井:10.1111 /j.1699-0463.1997.tb05047.x。PMID 9269296。S2CID 21902484。 ^ Bhise SB、Nalawade AD、Wadhawa H。「癌治療におけるプロテインチロシンキナーゼ阻害剤の役割」。Indian Journal of Biochemistry&Biophysics。41(6):273–80。PMID 22900354。 ^ Gunby RH、Sala E、Tartari CJ、Puttini M、Gambacorti-Passerini C、Mologni L。「抗癌療法の分子標的としての発癌性融合チロシンキナーゼ」。医薬品化学における抗がん剤。7(6):594–611。土井:10.2174 / 187152007784111340。PMID 18045055。 ^ ワインバーグ、ロバートA.(2007)。 癌の生物学。ニューヨーク:Garland Science、Taylor&Francis Group、LLC。pp。757–759。ISBN 978-0-8153-4076-8。
^ l m Kris MG、Natale RB、Herbst RS、Lynch TJ、Prager D、Belani CP、Schiller JH、Kelly K、Spiridonidis H、Sandler A、Alban KS、Cella D、 Wolf MK、Averbuch SD、Ochs JJ、Kay AC。「非小細胞肺癌の症候性患者における上皮成長因子受容体チロシンキナーゼの阻害剤であるゲフィチニブの有効性:ランダム化試験」。JAMA。290(16):2149–58。土井:10.1001 /jama.290.16.2149。PMID 14570950。 ^ Sordella R、Bell DW、Haber DA、Settleman J。「肺癌におけるゲフィチニブ感作性EGFR変異は抗アポトーシス経路を活性化する」。科学。305(5687):1163–7。Bibcode:2004Sci … 305.1163S。土井:10.1126 /science.1101637。PMID 15284455。S2CID 34389318。 ^ 岡本I。「腫瘍発生に関連する上皮成長因子受容体:EGFRを標的とした抗癌療法」。FEBSジャーナル。277(2):309–15。土井:10.1111 /j.1742-4658.2009.07449.x。PMID 19922468。 ^ Druker BJ、Talpaz M、Resta DJ、Peng B、Buchdunger E、Ford JM、Lydon NB、Kantarjian H、Capdeville R、Ohno-Jones S、Sawyers CL。「慢性骨髄性白血病におけるBCR-ABLチロシンキナーゼの特異的阻害剤の有効性と安全性」(PDF)。ニューイングランドジャーナルオブメディシン。344(14):1031-1037。土井:10.1056 / NEJM200104053441401。PMID 11287972。S2CID 8399298。2019-02-19にオリジナル(PDF)からアーカイブされました。
^ Joensuu H、Roberts PJ、Sarlomo-Rikala M、Andersson LC、Tervahartiala P、Tuveson D、Silberman S、Capdeville R、Dimitrijevic S、Druker B、Demetri GD。「転移性消化管間質腫瘍患者におけるチロシンキナーゼ阻害剤STI571の効果」。ニューイングランドジャーナルオブメディシン。344(14):1052–6。土井:10.1056 / NEJM200104053441404。PMID 11287975。 ^ ブランケCD、デメトリGD、フォンメーレンM、ハインリッヒMC、アイゼンバーグB、フレッチャーJA、コーレスCL、フレッチャーCD、ロバーツPJ、ハインツD、ウェーレE、ニコロワZ、ヨエンスーH。「KITを発現している切除不能または転移性消化管間質腫瘍の患者を対象とした、標準用量と高用量のメシル酸イマチニブのランダム化第II相試験の長期結果」。臨床腫瘍学ジャーナル。26(4):620–5。CiteSeerX 10.1.1.690.6356。土井:10.1200 /JCO.2007.13.4403。PMID 18235121。 ^ le Coutre P、Ottmann OG、Giles F、Kim DW、Cortes J、Gattermann N、Apperley JF、Larson RA、Abruzzese E、O’Brien SG、Kuliczkowski K、Hochhaus A、Mahon FX、Saglio G、Gobbi M 、Kwong YL、Baccarani M、Hughes T、Martinelli G、Radich JP、Zheng M、Shou Y、Kantarjian H。「選択性の高いBCR-ABLチロシンキナーゼ阻害剤であるニロチニブ(旧AMN107)は、イマチニブ耐性または不耐性の加速期慢性骨髄性白血病の患者に有効です」。血。111(4):1834–9。土井:10.1182 / blood-2007-04-083196。PMID 18048643。 ^ 桑井T、中村T、佐々木T、キムSJ、ファンD、ビジャレスGJ、ジグラーM、ワンH、バーエリM、カーベルRS、フィドラーIJ。「腫瘍関連内皮細胞上のリン酸化上皮成長因子受容体は、チロシンキナーゼ阻害剤による治療の主要な標的です」。新生物。10(5):489–500。土井:10.1593 /neo.08200。PMC 2373870。PMID 18472966。 ^ Rivera-Torres J、JoséES(2019)。「Srcチロシンキナーゼ阻害剤:それらの免疫、抗ウイルス、および老化療法の可能性に関する新しい展望」。薬理学のフロンティア。10:1011 DOI:10.3389 / fphar.2019.01011。PMC 6759511。PMID 31619990。
外部リンク
真核生物の線形モチーフリソースモチーフクラスMOD_TYR_CSK
チロシンキナーゼグループ
UniProtのPDBで利用可能なすべての構造情報の概要:PDBe-KBのP08631(チロシンプロテインキナーゼHCK)。
UniProtのPDBで利用可能なすべての構造情報の概要:PDBe-KBのP00520(チロシンプロテインキナーゼABL1)。
UniProtのPDBで利用可能なすべての構造情報の概要:PDBe-KBのO60674(チロシンプロテインキナーゼJAK2)。
![]()
生物学ポータル”
